
科目: 来源: 题型:
【题目】2SO2(g) + O2(g) ![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2 L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中,正确的是
甲 | 乙 | 丙 | ||
起始物质的量 | n(SO2) / mol | 0.4 | 0.8 | 0.8 |
n(O2) / mol | 0.24 | 0.24 | 0.48 | |
SO2的平衡转化率 / % | 80 | α1 | α2 | |
A. 甲中反应的平衡常数小于乙
B. 平衡时,丙中c(SO3)是甲中的2倍
C. 该温度下,平衡常数值为400
D. 平衡时,甲中O2的转化率大于乙中O2的转化率
查看答案和解析>>
科目: 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目: 来源: 题型:
【题目】将制得的锰粉碎后加入到SnCl2溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应Mn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)。
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)。
(1)为加快反应速率可以采取的措施有____________、____________;
(2)不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________。
(3)下列能说明反应已达平衡的有____________ (填编号)。
A.溶液的颜色不发生变化 B.溶液中c(Mn2+)=c( Sn2+)
C.体系中固体的质量不变 D.Mn2+与Sn2+浓度的比值保持不变
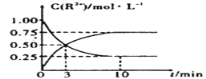
(4)室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=____________。若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则再次平衡时c(Mn2+) =____________ (不考虑离子水解的影响)。
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。

下列说法不正确的是
A. 异戊二烯所有碳原子可能共平面
B. 可用溴水鉴别M和对二甲苯
C. 对二甲苯的一氯代物有2种
D. M的某种同分异构体含有苯环且能与钠反应放出氢气
查看答案和解析>>
科目: 来源: 题型:
【题目】⑴在①NaCl、②NaOH、③N2、④H2S、⑤Na2O2中,只含有离子键的是________,只含有极性键的是______,既含离子键又含非极性共价键的是____。
(2)写出下列物质的电子式:
CO2____________NaCl____________ HClO_______________
查看答案和解析>>
科目: 来源: 题型:
【题目】H2R为二元弱酸,向一定体积的0.1mol/L的H2R溶液中逐滴加入一定浓度的NaOH溶液,溶液中不同形态的粒子(H2R、HR-、R2-)的物质的量分数a(X)随pH的变化曲线如图所示[a(X)=c(X)/[c(H2R)+c(HR-)+c(R2-)]]。下列说法错误的是
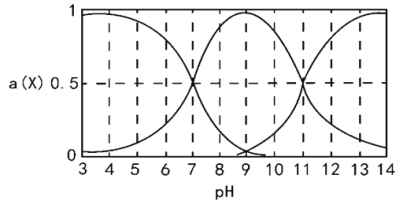
A. 常温下,K2(H2R)=1.0×10-11
B. 常温下,HR-在水中的电离程度大于其水解程度
C. pH=9时, c(Na+)>c(HR-)+2c(R2-)
D. pH=7时,c(H2R)=c(HR-)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A-O分别代表一种物质,它们之间的转化关系如下图所示(反应条件略去)。A、B、H分别是由短周期元素组成的单质.B与冷水缓慢反应,与沸水迅速反应,放出氢气.D是一种离子化合物,其阴阳离子的个数比为2:3,且能与水反就应得到两种碱.C为淡黄色固体化合物,O能与G的水溶液反应生成蓝色沉淀.

请回答下列问题:
(1)组成B单质的元素在周期表第 周期第 族 .化合物C的电子式为 .
(2)J的沸点比硒化氢(H2Se)的沸点高,其原因是
(3)写出I与H在点燃条件下反应生成A和J的化学方程式:
(4)写出D与足量的N反应生成E和F的化学方程式;
(5)上图中,在同一反应里一种物质既作氧化剂,又作还原剂,这样的反应共有 个.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如Fe+Cu2+=Fe2++Cu,可拆写为氧化反应式:Fe-2e-=Fe2+,还原反应式:Cu2++2e-=Cu。据此,回答下列问题:
(1)将反应Zn+2H+=Zn2++H2↑拆写为两个“半反应式”:
氧化反应式:_______________________,还原反应式:_______________________。
(2)将反应2Fe3++Cu=2Fe2++Cu2+拆写为两个“半反应式”:
氧化反应式:_______________________,还原反应式:_______________________。
(3)已知某反应的两个“半反应式”为:氧化反应式CH4+10OH--8e-=![]() +7H2O,还原反应式O2+2H2O+4e-=4OH-,则氧化还原反应方程式为___________________。
+7H2O,还原反应式O2+2H2O+4e-=4OH-,则氧化还原反应方程式为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E是短周期的5种元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出B、D元素的名称:B______________,D______________。
(2)画出C元素的离子结构示意图_____________________________。
(3)写出D的单质与C的最高价氧化物对应水化物之间反应的离子方程式_________。
(4)A、B、C三种元素形成的化合物为_____________________, 所含的化学键类型为_______________________。
(5)B、C、D三种元素的离子半径由大到小的排列顺序为__________________(用离子符号表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com