
【题目】将制得的锰粉碎后加入到SnCl2溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应Mn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)。
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)。
(1)为加快反应速率可以采取的措施有____________、____________;
(2)不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________。
(3)下列能说明反应已达平衡的有____________ (填编号)。
A.溶液的颜色不发生变化 B.溶液中c(Mn2+)=c( Sn2+)
C.体系中固体的质量不变 D.Mn2+与Sn2+浓度的比值保持不变
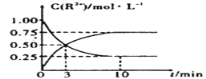
(4)室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=____________。若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则再次平衡时c(Mn2+) =____________ (不考虑离子水解的影响)。
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为______。
【答案】升高温度 增大c(Sn2+) 构成多个微型原电池,加快反应速率 ACD 3 0.375molL-1 Mn2+ —2e- +2H2O=MnO2 + 4H+
【解析】
根据加快反应速率的因素有升温、加压、增大浓度、加入催化剂、增大接触面积、构成原电池加快反应速率等措施分析解答(1)、(2);
(3)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
(4)根据图像,平衡状态下Mn2+(aq)浓度为0.75mol/L,Sn2+(aq)浓度0.25mol/L,结合平衡常数表达式计算K;根据温度不变,平衡常数不变,分析判断;
(5)阳极发生氧化反应,锰由+2价变成+4价,据此书写阳极的电极反应式。
(1)反应Mn(s)+Sn2+(aq)Mn2+(aq)+Sn(s),压强影响不大,增大反应速率的因素主要是升温、增大c(Sn2+)离子浓度,故答案为:升高温度;增大c(Sn2+);
(2)不考虑温度因素,一段时间后,置换出的Sn与Mn构成多个微型原电池,加快反应速率,因此Mn的溶解速率加快,故答案为:构成多个微型原电池,加快反应速率;
(3)反应Mn(s)+Sn2+(aq)Mn2+(aq)+Sn(s)(已知含Sn2+水溶液为米黄色)。A.溶液的颜色不发生变化,说明离子浓度不变,说明反应达到平衡状态,故A正确;B.溶液中c(Mn2+)=c( Sn2+)和起始浓度有关,与平衡状态无直接关系,故B错误;C.体系中固体的质量不变,说明溶液中离子浓度不变,反应达到平衡状态,故C正确;D.Mn2+与Sn2+浓度的比值保持不变说明正逆反应速率相同,反应达到平衡状态,故D正确;故答案为:ACD;
(4)根据图像可知,平衡状态下Mn2+(aq)浓度为0.75mol/L,Sn2+(aq)浓度0.25mol/L,平衡常数K=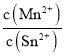 =
=![]() =3;若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,由于温度不变,平衡常数不变,因此浓度变为原来的一半=
=3;若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,由于温度不变,平衡常数不变,因此浓度变为原来的一半=![]() ×0.75mol/L=0.375molL-1,故答案为:3;0.375molL-1;
×0.75mol/L=0.375molL-1,故答案为:3;0.375molL-1;
(5)阳极发生氧化反应,锰由+2价变成+4价,电极反应为Mn2++2H2O-2e-=MnO2+4H+,故答案为:Mn2+-2e-+2H2O=MnO2+4H+。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计甲、乙、丙三种装置(C1、C2、C3均为石墨)。下列叙述正确的是( )
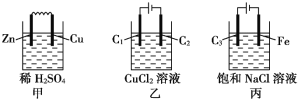
A. 甲、丙中是化学能转化为电能,乙中是电能转化为化学能
B. C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应
C. C1上和C3上放出的气体相同,铜片上和铁片上放出的气体也相同
D. 甲中溶液的pH逐渐升高,丙中溶液的pH逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li/Li2O体系的能量循环图如图所示。已知,△H4>0。下列说法正确的是
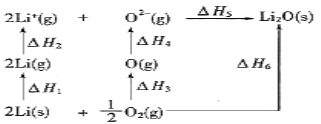
A. △H3<0
B. △H3+△H4+△H5=△H6
C. △H6>△H5
D. △H1+△H2+△H3+△H4+△H5+△H6=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
CO | H2O | CO2 | H2 | |||
① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量_____________(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为_____________。
(3)计算容器①中反应的平衡常数K=_____________。某时刻测得②中氢气的物质的量为1.8mol,请问此刻V正 V逆(填大于,小于或等于)
(4)下列叙述正确的是_____________(填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,两容器中CO的转化率相同
(5)已知:2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ/mol,请写出CO完全燃烧生成CO2的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
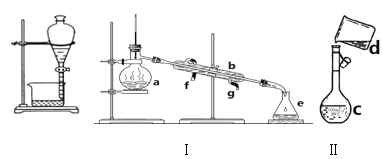
(1)写出下列仪器的名称:a.___,b.___,c.___,d.___。
(2)若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是___,冷凝水由___(填f或g)口通入。
(3)现需配制0.25mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
①图中的错误是___。
②根据计算得知,需称量NaOH的质量为___g。
③下列操作使配制的NaOH溶液浓度偏低的有____。
A.将砝码放在左盘上,NaOH放在右盘上进行称量(使用游码)
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
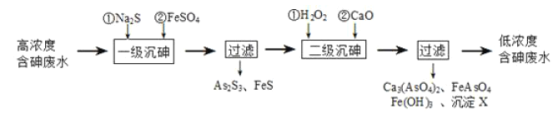
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____;砷酸的第一步电离方程式为______。
(2)“一级沉砷”中FeSO4的作用是_____;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______。
(3)沉淀X为____(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第三周期11![]() 17号元素某些性质变化趋势的柱形,下列有关说法中正确的是( )
17号元素某些性质变化趋势的柱形,下列有关说法中正确的是( )

A. y轴表示的可能是电离能 B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径 D. y轴表示的可能是形成基态离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的的是
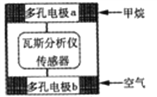
A. 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B. 电极b是正极,O2-由电极a流向电极b
C. 当固体电解质中有1 mol O2-通过时,电子转移4 mol
D. 电极a的反应式为:CH4+5O2-―8e-=CO32- +2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com