
【题目】Li/Li2O体系的能量循环图如图所示。已知,△H4>0。下列说法正确的是
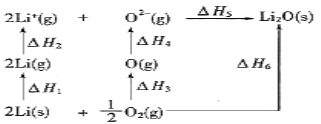
A. △H3<0
B. △H3+△H4+△H5=△H6
C. △H6>△H5
D. △H1+△H2+△H3+△H4+△H5+△H6=0
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】石墨烯可看作将石墨的层状结构一层一层地剥开得到的单层碳原子;石墨炔是平面网状结构的全碳分子,具有优良的化学稳定性和半导体性能,还可用于H2的提纯;将氢气氢化到石墨烯排列的六角晶格中,使每个碳原子都增加一个氢原子可得最薄的绝缘新材料石墨烷。下列有关说法中不正确的是
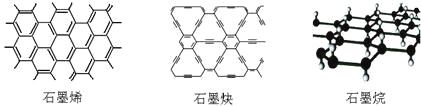
A. 石墨烯和石墨炔互为同素异形体
B. 石墨炔有望替代二氧化硅用作半导体材料
C. 12g石墨烯完全转变为石墨烷需标况下11.2L氢气
D. 石墨炔孔径略大于H2分子的直径,因此它是理想的H2提纯薄膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液
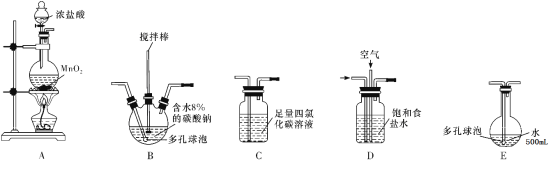
回答下列问题:
(1)各装置的连接顺序为______→_____→_____→____→E。
(2)装置A中反应的离子方程式是______。
(3)装置E中反应的化学方程式是_____。
(4)装置B中多孔球泡和搅拌棒的作用是_______;反应过程中,装置B需放在冷水中,其目的是_____。
(5)装置C的主要作用是_____。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学把小块木炭在酒精灯上烧至红热,迅速投入热的浓硝酸中,发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧发出亮光。经查阅资料可知浓硝酸分解产生NO2和O2。为了探究“液面上木炭迅速燃烧发出亮光”的原因,该小组同学用如图装置完成以下实验:
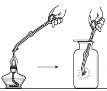
序号 | 实验I | 实验II |
集气瓶中所盛气体 | O2 | 加热浓硝酸 产生的气体 |
现象 | 木炭迅速燃烧发出亮光 | 木炭迅速燃烧发出亮光 |
下列说法正确的是
A. 浓硝酸分解产生的V(NO2):V(O2)=1:1
B. 红棕色气体的产生表明木炭与浓硝酸发生了反应
C. 能使液面上木炭迅速燃烧发出亮光的主要气体是氧气
D. 以上实验不能确定使液面上木炭迅速燃烧发出亮光的主要气体一定是NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A分子式为C9H10O2,B的相对分子质量比A大79,J是乙酸,K是聚乙酸乙烯酯的单体,G与氯化铁溶液能发生显色反应,且苯环上的一元取代物只有两种。A→K之间有如下转化关系:
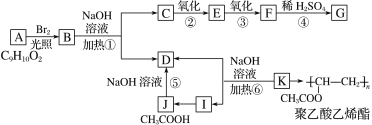
已知:①当羟基与双键碳原子相连时,易发生转化:RCH==CHOH→RCH2CHO
②—ONa连在烃基上不会被氧化。
请回答下列问题:
(1)化合物K的结构简式是_______。I中官能团的名称为______。
(2)反应①④⑤⑥中属于水解反应的是___(填反应编号)。由C→G操作顺序为②③④,而不采取④②③,原因是______。
(3)G可以与NaHCO3溶液反应,1 molG与NaHCO3溶液反应时最多消耗____molNaHCO3。
(4)写出B→C+D的化学方程式_____________。
(5)同时符合下列要求的A的同分异构体有________种(不考虑立体异构)。
Ⅰ.含有苯环;Ⅱ.能发生银镜反应和水解反应。
在这些同分异构体中,满足下列条件的同分异构体的结构简式为________。
①核磁共振氢谱有5个吸收峰;②1mol该同分异构体只能与1molNaOH反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
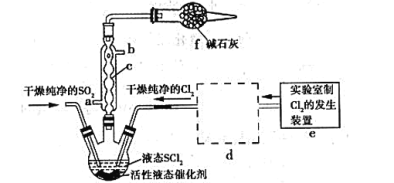
【题目】亚硫酰氯(俗称氯化亚砜,SOCl2)是一种液态化合物,沸点77℃,在农药、制药行业、有机合成等领域用途广泛。SOCl2遇水剧烈反应,液面上产生白雾,并常有刺激性气味的气体产生,实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示:
请回答下列问题:
(1)装置f的作用是_____。
(2)实验室用二氧化锰制备Cl2的离子方程式为_____。
(3)SOCl2遇水剧烈反应,液面上产生白雾,并伴有刺激性气味的气体,写出有关反应的化学方程式_____。
(4)下列制备SO2的原理中最佳选择是____。
A.Cu与浓硫酸混合共热
B.Na2S2O3溶液与稀硫酸混合反应
C.Na2SO3固体与70%的H2SO4混合反应
D.Na2SO3固体与4mol·L﹣1的HNO3混合反应
(5)装置e中产生的Cl2经过装置d后进入三颈烧瓶,d中所用的试剂为___。(按气流方向)
(6)若反应中消耗Cl2的体积为672mL(己转化为标准状况,SO2足量),最后得到纯净的SOCl2 4.76g,则SOCl2的产率为____(保留三位有效数字)。
(7)实验结束后,将三颈烧瓶中混合物分离开的实验操作是____(己知SCl2的沸点为50℃)。分离产物后,向获得的SOCl2中加入足量NaOH溶液,振荡、静置得到无色溶液W,检验溶液W中存在Cl-的方法是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 往澄清石灰水中通入少量的二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
B. 往碳酸钠溶液中通入二氧化碳:CO![]() +CO2+H2O ===HCO3-
+CO2+H2O ===HCO3-
C. 二氧化硅与烧碱溶液反应:SiO2+2OH-===SiO![]() +H2↑
+H2↑
D. 氯化铁腐蚀铜电路板:Fe3++Cu===Fe2++Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
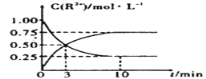
【题目】将制得的锰粉碎后加入到SnCl2溶液中使其浸出(假定杂质不反应,溶液体积不变),发生反应Mn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)。
Mn2+(aq)+ Sn(s)(已知含Sn2+水溶液为米黄色)。
(1)为加快反应速率可以采取的措施有____________、____________;
(2)不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是____________。
(3)下列能说明反应已达平衡的有____________ (填编号)。
A.溶液的颜色不发生变化 B.溶液中c(Mn2+)=c( Sn2+)
C.体系中固体的质量不变 D.Mn2+与Sn2+浓度的比值保持不变
(4)室温下,测得溶液中阳离子浓度c(R2+)随时间的变化情况如下图所示,则上述反应的平衡常数K=____________。若其他条件不变,10min后向容器中迅速加入蒸馏水至溶液体积变为原来的2倍,则再次平衡时c(Mn2+) =____________ (不考虑离子水解的影响)。
(5)MnO2也可在MnSO4-H2SO4-H2O为体系的电解液中电解获得,其阳极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
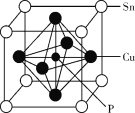
【题目】磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的电子排布式为_____,其基态原子的价电子运动状态有___种。基态磷原子的外围电子轨道表示式____
(2)磷化铜与水作用产生有毒的磷化氢(PH3),其分子空间构型______。
(3)磷青铜中的锡、磷两种元素电负性的大小为Sn___P(填“>”“<”或“=”)。
(4)某磷青铜晶胞结构如图所示。
①则其化学式为_______。
②该晶体中距离Cu原子最近的Sn原子有___个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com