
【题目】次氯酸溶液是常用的消毒剂、漂白剂。某学习小组根据需要欲制备浓度不小于0.8mol/L的次氯酸溶液。
(查阅资料)
资料1:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水立即反应生成HClO。
资料2:将氯气和空气(不参与反应)按体积比1∶3混合通入潮湿的碳酸钠中发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,用水吸收Cl2O(不含Cl2)制得次氯酸溶液。
(装置及实验)用以下装置制备次氯酸溶液
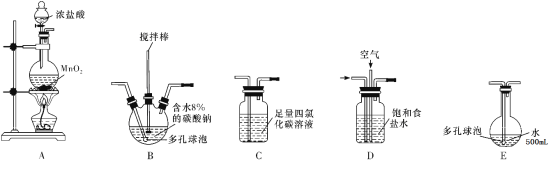
回答下列问题:
(1)各装置的连接顺序为______→_____→_____→____→E。
(2)装置A中反应的离子方程式是______。
(3)装置E中反应的化学方程式是_____。
(4)装置B中多孔球泡和搅拌棒的作用是_______;反应过程中,装置B需放在冷水中,其目的是_____。
(5)装置C的主要作用是_____。
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是(答出一条即可)_____。
【答案】A D B C MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O Cl2O+H2O=2HClO 加快反应速率,使反应充分进行 防止反应放热后温度过高导致Cl2O分解 除去Cl2O中的Cl2 制得的次氯酸溶液浓度较大或制得的次氯酸溶液纯度较高或制得的次氯酸溶液不含有Cl离子或氯元素的利用率高等
Mn2++Cl2↑+2H2O Cl2O+H2O=2HClO 加快反应速率,使反应充分进行 防止反应放热后温度过高导致Cl2O分解 除去Cl2O中的Cl2 制得的次氯酸溶液浓度较大或制得的次氯酸溶液纯度较高或制得的次氯酸溶液不含有Cl离子或氯元素的利用率高等
【解析】
A装置用二氧化锰和浓盐酸制备氯气,由D装置饱和食盐水吸收氯气中的氯化氢气体,与空气形成1:3的混合气体通入B装置,发生反应2Cl2+2Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3,防止反应放热后温度过高导致Cl2O分解,装置B需放在冷水中,在搅拌棒的作用下与含水8%的碳酸钠充分反应制备Cl2O,通入C装置吸收除去Cl2O中的Cl2,并在E装置中用水吸收Cl2O制备次氯酸溶液,据此分析作答。
(1)A装置制备氯气,D装置吸收吸收氯气中的氯化氢气体,与空气形成1:3的混合气体通入B装置,与含水8%的碳酸钠充分反应制备Cl2O,C装置吸收除去Cl2O中的Cl2,E装置中用水吸收Cl2O制备次氯酸溶液,所以各装置的连接顺序为A→D→B→C→E;
(2)二氧化锰与浓盐酸在加热条件下反应生成氯气,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2Cl- ![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)E装置中用水吸收Cl2O制备次氯酸溶液,反应的方程式为:Cl2O+H2O ![]() 2HClO;
2HClO;
(4)装置B中多孔球泡增大接触面积、搅拌棒的作用增加接触机会,两者的作用是加快反应速率,使反应充分进行;由题可知:Cl2O 42℃以上会分解生成Cl2和O2,故为防止反应放热后温度过高导致Cl2O分解,装置B需放在冷水中;
(5)Cl2O为极性分子,Cl2为非极性分子,根据相似相容原理,氯气易溶于四氯化碳,可在装置C中除去Cl2O中的Cl2;
(6)此方法相对于用氯气直接溶于水制备次氯酸溶液的优点是:制得的次氯酸溶液浓度较大或制得的次氯酸溶液纯度较高或制得的次氯酸溶液不含有Cl-离子或氯元素的利用率高等。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】乙二酸,又称草酸,通常在空气中易被氧化而变质。其两分子结晶水(H2C2O4·2H2O)却能在空气中稳定存在。在分析化学中常用H2C2O4·2H2O做KMnO4的滴定剂,下列关于H2C2O4的说法正确的是
A.草酸是二元弱酸,其电离方程式为H2C2O4![]() 2H++C2O
2H++C2O![]()
B.草酸滴定KMnO4属于中和滴定,可用石蕊做指示剂
C.乙二酸可通过乙烯经过加成、水解、氧化再氧化制得
D.将浓H2SO4滴加到乙二酸上使之脱水分解,分解产物是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推的思维方法在化学学习和研究中有时会产生错误的结论,因此类比推出的结论最终要经过实践的检验才能决定其正确与否。下列类推结论中正确的是( )
A.Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B.Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·Pb2O3
C.Cu与Cl2直接化合生成CuCl2;Cu与S直接化合也能得到CuS
D.CO2通入到硝酸钡溶液中不能生成沉淀;SO2通入到硝酸钡溶液中也不能生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计甲、乙、丙三种装置(C1、C2、C3均为石墨)。下列叙述正确的是( )
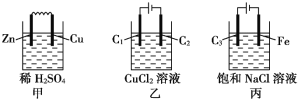
A. 甲、丙中是化学能转化为电能,乙中是电能转化为化学能
B. C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应
C. C1上和C3上放出的气体相同,铜片上和铁片上放出的气体也相同
D. 甲中溶液的pH逐渐升高,丙中溶液的pH逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D.步骤(2)产物中残留的丙烯醇可用溴水检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出)
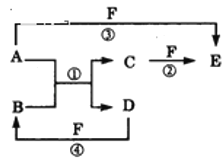
(1)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子最外层电子数D是A的2倍,③与④两个反应中都有红棕色气体生成,反应④的离子方程式是__,用电子式表示C的形成过程__,六种物质中所有元素的原子半径由大到小的顺序为__(用元素符号表示)。
(2)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则C的化学式为__,E的结构式为__,A、D、F所对应元素的气态氢化物的稳定性,由强到弱的顺序是__(用化学式表示),反应①的化学方程式是__。
(3)若B、C、F都是气态单质,且B为黄绿色,③和④两个反应中都有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,反应①的化学方程式是__,在反应中若有3mol电子转移,则生成C的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li/Li2O体系的能量循环图如图所示。已知,△H4>0。下列说法正确的是
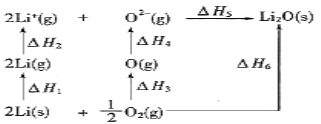
A. △H3<0
B. △H3+△H4+△H5=△H6
C. △H6>△H5
D. △H1+△H2+△H3+△H4+△H5+△H6=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
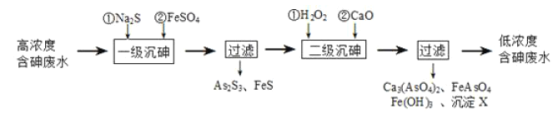
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____;砷酸的第一步电离方程式为______。
(2)“一级沉砷”中FeSO4的作用是_____;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______。
(3)沉淀X为____(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com