
【题目】磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的电子排布式为_____,其基态原子的价电子运动状态有___种。基态磷原子的外围电子轨道表示式____
(2)磷化铜与水作用产生有毒的磷化氢(PH3),其分子空间构型______。
(3)磷青铜中的锡、磷两种元素电负性的大小为Sn___P(填“>”“<”或“=”)。
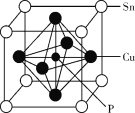
(4)某磷青铜晶胞结构如图所示。
①则其化学式为_______。
②该晶体中距离Cu原子最近的Sn原子有___个。
【答案】1s22s22p63s23p63d104s1 11 ![]() 三角锥型 < SnCu3P 4
三角锥型 < SnCu3P 4
【解析】
(1)根据洪特规则书写基态铜原子的电子排布式;基态原子的价电子排布式是3d104s1;磷原子核外有15个电子,基态磷原子的电子排布式是1s22s22p63s23p3;
(2)磷化氢(PH3)中磷原子的价电子对数是![]() ,有1个孤电子对;
,有1个孤电子对;
(3)元素非金属性越强,电负性越强;
(4)①根据均摊原则计算晶胞的化学式;
②根据磷青铜晶胞结构图判断距离Cu原子最近的Sn原子的个数。
(1)铜原子核外有29个电子,基态铜原子的电子排布式为1s22s22p63s23p63d104s1;基态原子的价电子排布式是3d104s1,有11个价电子,所以有11种运动状态;基态磷原子的电子排布式是3s23p3,外围电子轨道表示式是![]() ;
;
(2)磷化氢(PH3)中磷原子的价电子对数是![]() ,有1个孤电子对,所以其分子空间构型是三角锥型;
,有1个孤电子对,所以其分子空间构型是三角锥型;
(3)元素非金属性越强,电负性越强,非金属性Sn<P,所以电负性Sn<P;
(4)①晶胞中Sn原子数=![]() 、Cu原子数=
、Cu原子数=![]() 、P原子数为1,晶胞的化学式是SnCu3P;
、P原子数为1,晶胞的化学式是SnCu3P;
②根据磷青铜晶胞结构图,距离Cu原子最近的Sn原子有4个。


科目:高中化学 来源: 题型:
【题目】Li/Li2O体系的能量循环图如图所示。已知,△H4>0。下列说法正确的是
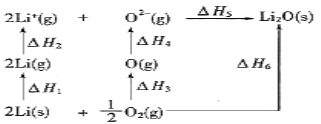
A. △H3<0
B. △H3+△H4+△H5=△H6
C. △H6>△H5
D. △H1+△H2+△H3+△H4+△H5+△H6=0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如图:
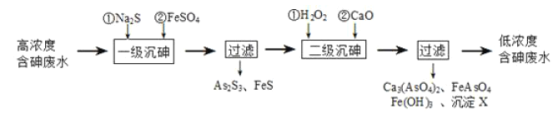
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为____;砷酸的第一步电离方程式为______。
(2)“一级沉砷”中FeSO4的作用是_____;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______。
(3)沉淀X为____(填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
(4)AsH3的电子式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是第三周期11![]() 17号元素某些性质变化趋势的柱形,下列有关说法中正确的是( )
17号元素某些性质变化趋势的柱形,下列有关说法中正确的是( )

A. y轴表示的可能是电离能 B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径 D. y轴表示的可能是形成基态离子转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | 原子核外有6种不同运动状态的电子 |
C | 基态原子中s电子总数与p电子总数相等 |
D | 原子半径在同周期元素中最大 |
E | 基态原子最外层电子排布式为3s23p1 |
F | 基态原子的最外层p轨道有两个电子的自旋方向与其他电子的自旋方向相反 |
G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
H | 是我国使用最早的合金中的最主要元素 |
请用化学用语填空:
(1) A元素在元素周期表中的位置________;A、B、C三种元素的第一电离能由大到小的排序为_____(用元素符号填写);
(2) B元素与宇宙中含量最丰富的元素形成的最简单化合物的分子构型为____,B元素所形成的单质分子中σ键与π键数目之比为____。
(3) G元素的低价阳离子的离子结构示意图是________,F元素原子的外围电子排布图是________,H元素的基态原子核外电子排布式是________。
(4) D元素的单质及其常见化合物的焰色反应主要利用了原子光谱中的______(A.原子吸收光谱B.原子发射光谱)
(5) 上述元素属于p区的是_______(用元素符号填写);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F有以下转化关系.A的产量是衡量一个国家石油化工生产水平的标志;D能使石蕊试液变红;E是不溶于水且具有水果香味的无色液体,相对分子质量是C的2倍;F是塑料的主要成分之一,常用于制食品包装袋。结合如图关系回答问题:

(1)按要求回答下列问题:
①写出A、E的结构简式:A___、E___;
②写出B、C、D中官能团的名称:B___、C___、D___;
③写出反应②的反应方程式:___。
(2)A与苯都是石油化工的重要产品,在一定条件下A可以转化生成苯,按要求回答下列问题:
①苯可以发生取代反应,写出由苯制备溴苯的化学反应方程式:___。
②纯净的溴苯是无色油状液体,实验室制得的粗溴苯通常因溶解了Br2呈褐色,可以加入试剂___除去,该除杂操作所必须的主要玻璃仪器是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒电池是一种新型酸性硫酸盐二次电池,钒电池失效后,废电解液回收利用的一种工艺如下:

已知:a.+5价钒在溶液中存在如下平衡: ![]() 。
。
b.部分含钒物质在水中的溶解性见下表:

(1)氧化工序中,其他价态的钒全部氧化成![]() ,完成
,完成![]() 氧化的离子方程式:
氧化的离子方程式:
_________V2++_________ClO3-+ _________=_________VO2+__________C1-+ __________NaClO和NaClO3均可作氧化剂,该工序中不选择NaClO作氧化剂的理由是_________。
(2)浓缩工序中,加入NaOH的作用是_________。
(3)沉钒工序的化学方程式为_________。
(4)煅烧偏钒酸铵时,固体(取234g NH4VO3)质量的减少量随温度变化的曲线如图所示,100~200℃时产生的一种气体的电子式为________,300~350℃时发生反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种瓦斯分析仪能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的的是
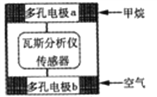
A. 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B. 电极b是正极,O2-由电极a流向电极b
C. 当固体电解质中有1 mol O2-通过时,电子转移4 mol
D. 电极a的反应式为:CH4+5O2-―8e-=CO32- +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1869年俄国化学家门捷列夫制出第一张元素周期表,到现在形成的周期表经过了众多化学家的艰辛努力,历经142年。元素周期表体现了元素位构性的关系,揭示了元素间的内在联系。如图是元素周期表的一部分,回答下列问题。
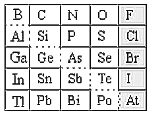
(1)元素Ga在元素周期表中的位置为:__________(写明周期和族)。
(2)Sn的最高正价为______,Cl的最高价氧化物对应水化物的化学式为_____,As的气态氢化物为_____。
(3)根据元素周期律,推断:
①阴影部分元素氢化物热稳定性最高的是_____(填化学式)。
②H3AsO4、H2SeO4的酸性强弱:H3AsO4_____H2SeO4(填“>”、“<”或“=”)。
③氢化物的还原性:H2O_____H2S(填“>”、“<”或“=”)。
(4)可在图中分界线(虚线部分)附近寻找_____(填序号)。
A.优良的催化剂 B.半导体材料 C.合金材料 D.农药
(5)①Se2Cl2常用作分析试剂,其电子式为_________。
②硒(Se)化铟(In)是一种可应用于未来超算设备的新型半导体材料。 下列说法正确的是_____(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
(6)请设计实验比较C、Si的非金属性强弱顺序(可供选择的药品有:CaCO3固体、稀硫酸、盐酸、饱和NaHCO3溶液、饱和Na2CO3溶液、硅酸钠溶液,化学仪器根据需要选择)。
实验步骤 | 实验现象与结论 |
在试管中加入_____,再加入_____,将生成气体通过_____洗气后,通入_____; | 现象:__________; 结论:非金属性C>Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com