
科目: 来源: 题型:
【题目】有机物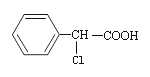 有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
有多种同分异构体,其中属于酯类且氯原子直接连在苯环上的同分异构体有多少种(不考虑立体异构)( )
A. 6种 B. 9种 C. 15种 D. 19种
查看答案和解析>>
科目: 来源: 题型:
【题目】图甲中①②③④表示不同化学元素所组成的化合物,图乙表示由四个单体构成的化合物。以下说法不正确的是( )
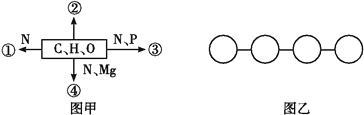
A. 若图甲中的②大量存在于皮下和内脏器官周围等部位,则②是脂肪
B. 若图甲中④能吸收、传递和转换光能,则④可用无水乙醇提取
C. 图乙中若单体是氨基酸,则该化合物彻底水解后的产物中氧原子数增加3个
D. 图乙中若单体是四种脱氧核苷酸,则该化合物彻底水解后的产物有5种
查看答案和解析>>
科目: 来源: 题型:
【题目】W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态价电子排布式可表示为_____。
(2)MX3-的空间构型是_________;H2X分子的空间构型为__________。
(3)从核外电子排布角度解释高温下Z2O比ZO更稳定的原因_________。
(4)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃,其晶胞结构如图所示。
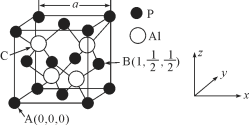
①磷化铝的晶体类型为_____。
②A、B点的原子坐标如图所示,则C点的原子坐标为____。
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为_____g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的数值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-,SO42-和NO3-的相互分离,实验过程如下:
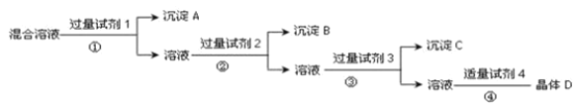
请回答下列问题:
(1)写出上述实验过程中所用试剂的名称:试剂1为 ___,试剂2为___,试剂4为_________。
(2)加入过量试剂3的目的是_________ 。
(3)在加入试剂4后,获得晶体D的实验操作④的名称是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是Na、Cu、Si、H、C、N等元素单质的熔点高低顺序,其中c、d均是热和电的良导体。
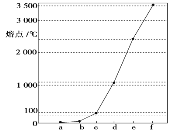
(1)请写出上图中e单质对应元素原子的电子排布式:________。
(2)a、b、f对应的元素以原子个数比1∶1∶1形成的分子中σ键和π键个数之比为___。
(3)图中d单质的晶体堆积方式类型是:____。
(4)a与b元素形成的10电子中性分子X的空间构型为_____;将X溶于水后的溶液滴入含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为___,其中X与d的高价离子之间以___键组合。
(5)下列是上述六种元素中的一种元素形成的含氧酸的结构:![]() ,请简要说明该物质易溶于水的原因:_____________。
,请简要说明该物质易溶于水的原因:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是物质A的一种制备方法以及由A引发的系列反应。
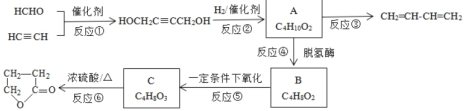
完成下列填空:
(1)HCHO中官能团的名称___。
(2)写出实验室制备CH![]() CH的化学方程式:__。
CH的化学方程式:__。
(3)写出反应类型。反应①:___反应,反应③:___反应。
(4)化合物B含酯基的同分异构体共4种,写出其余3种的结构简式:___。
(5)如何检验B是否完全转化为C?__。
(6)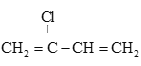 是制备氯丁橡胶的原料,以下是一种以CH2=CH-CH=CH2为原料制备
是制备氯丁橡胶的原料,以下是一种以CH2=CH-CH=CH2为原料制备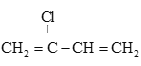 的合成路线的一部分,请补全其余3步:CH2=CH-CH=CH2
的合成路线的一部分,请补全其余3步:CH2=CH-CH=CH2 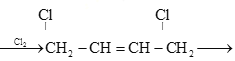 ________,(合成路线常用的表示方式为:甲
________,(合成路线常用的表示方式为:甲![]() 乙……
乙……![]() 目标产物)
目标产物)
查看答案和解析>>
科目: 来源: 题型:
【题目】砷(As)是第四周期VA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。
完成下列填空:
(1)砷原子核外有__个电子层,最外层有__个电子,写出砷原子最外层电子的轨道表示式:__。
(2)将砷与VA族所有短周期元素的原子半径,按从小到大的顺序排列:__(用元素符号表示)。
(3)溴位于VIIA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:__强于__(填物质的化学式)。
(4)周期表中,铝和砷都在金属和非金属过渡线附近,举一例说明铝元素具有非金属性:__。
(5)已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
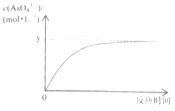
①写出该反应平衡常数的表达式K=___。
②不能判断反应达到平衡状态的是___(选填编号)。
A.溶液的pH不再变化
B.v(I-)=2v(AsO33-)
C.c(AsO33-)/c(I-)不再变化
D.c(I-)=2ymol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础。下列与“物质的量”相关的计算正确的( )
A.现有CO、CO2、O3三种气体,它们分别都含有1molO,则三种气体的物质的量之比为 3∶2∶1
B.5.6g CO 和22.4L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为 35.5m/n
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常采取以下方法除去H2S和SO2以减少有害气体的排放。完成下列填空:
I.H2S的除去
用Fe2(SO4)3溶液吸收H2S生成FeSO4。FeSO4被O2氧化使Fe2(SO4)3再生,其原理为:□FeSO4+□O2+□H2SO4![]() □Fe2(SO4)3+□ 。
□Fe2(SO4)3+□ 。
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍。由图1和图2判断,使用硫杆菌的最佳条件为__;若反应温度过高,反应速率下降,其原因是__。
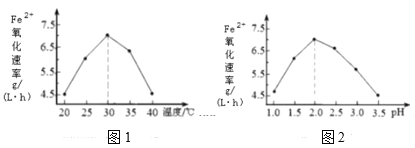
(2)补全、配平Fe2(SO4)3再生的化学方程式,并标出电子转移的数目和方向。______。
(3)在一定条件下,也可以用H2O2氧化H2S,其氧化产物随参加反应的n(H2O2)/n(H2S)变化而不同,当n(H2O2)/n(H2S)=4时,氧化产物的化学式为__。
II.SO2的除去
用NaOH溶液吸收SO2,并用CaO使NaOH再生:NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
(4)写出过程①的离子方程式:___。
(5)CaO在水中存在如下转化:CaO(s)+H2O(l)=Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理____。
Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理____。
(6)也可用氨水除去SO2。某废气含0.2%SO2和10%SO2(体积含量,其余为N2),一定条件下,该废气以5m3/h的速率通过催化剂与速率为20L/h的NH3混合,再喷水,得到(NH4)2SO4晶体(气体体积均已折算为标准状况)。通过计算说明NH3速率控制在20L/h的原因。________。
查看答案和解析>>
科目: 来源: 题型:
【题目】溴酸银(AgBrO3)和KNO3的溶解度随温度变化曲线如图所示:


下列分析错误的是( )
A.60℃时,AgBrO3,饱和溶液的浓度是0.596%
B.温度升高时AgBrO3,和KNO3溶解速度都加快
C.温度对AgBrO3,溶解度的影响比对KNO3溶解度的影响大
D.KNO3中少量AgBrO3可用重结晶的方法除去
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com