
科目: 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:
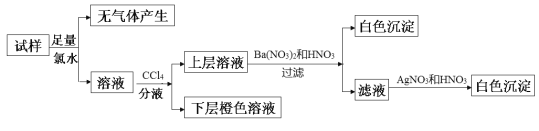
则关于原溶液的判断不正确的是
A.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)![]() 中心原子轨道的杂化类型为___________;
中心原子轨道的杂化类型为___________;![]() 的空间构型为_____________(用文字描述)。
的空间构型为_____________(用文字描述)。
(2)Fe2+基态价电子排布图为__________________。
(3)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法不正确的是 ( )
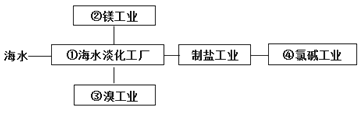
A.①中可采用蒸馏法
B.②中将MgCl2溶液蒸干即可得到无水MgCl2
C.③中提溴涉及到氧化还原反应
D.④的产品可生产盐酸、漂白液等
查看答案和解析>>
科目: 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为 _________________________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)________I1(Cu)(填“大于”或“小于”)。原因是______________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是______________________。
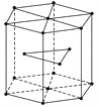
(4)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为____________________。六棱柱底边边长为acm,高为ccm,阿伏加德罗常数的值为NA,Zn的密度为________g·cm-3。
查看答案和解析>>
科目: 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目: 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中不正确的是( )
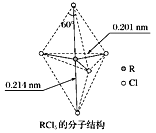
A. 每个原子都达到8电子稳定结构
B. 键角(Cl—R—Cl)有90°、120°、180°几种
C. RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3
D. 分子中5个R—Cl键键能不都相同
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。
下列说法错误的是( )
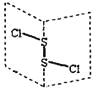
A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目: 来源: 题型:
【题目】早在2000多年前,人们发现柳树皮中含有一种具有解热镇痛功效的物质—水杨酸,此后科学家对水杨酸的结构进行一系列改造,合成出疗效更佳的长效缓释阿司匹林,其开发过程蕴含着重要的思想方法,请回答下列问题:
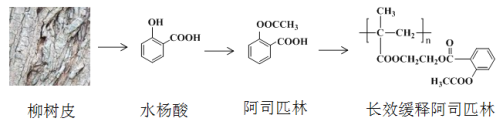
(1)水杨酸的结构与性质
①水杨酸中含氧官能团的名称是____________、______________。
②下列关于水杨酸的说法正确的是__________。
A.分子式为C7H7O3
B.1 mol水杨酸能与2 molNaOH反应
C.可发生加成、取代、消去反应
(2)水杨酸的合成
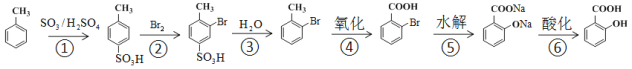
①由![]() 制
制![]() ,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
,不采取甲苯直接与Br2直接反应,而是经过步骤①~③,目的是_______________
②步骤④~⑥的顺序能够改为水解、酸化、氧化?____________(填“能”或“不能”),理由是__________________________________
(3)水杨酸具有解热镇痛的功效,但是其酸性很强,对人的肠胃有刺激性,容易引发胃溃疡,1897年德国化学家菲利克斯·霍夫曼对水杨酸的结构进行改造合成出阿司匹林。
①水杨酸的酸性主要来源于-COOH,将-OH转化为-OOCCH3,可使-COOH的酸性大大降低。科学家的这一设计思路依据的原理是_________________________________________
②水杨酸到阿司匹林的反应类型是_________
(4)1982年拜尔公司将阿司匹林与聚甲基丙烯酸借助乙二醇嫁接起来,研制出长效缓释阿司匹林,可减少每天吃药次数,大大方便了人们对药物的使用。
①长效缓释阿司匹林在人体内释放出阿司匹林的反应类型是______________
②写出乙烯经2步合成乙二醇的化学方程式_______________________、________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度时,反应X(g)![]() 4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法不正确的是
4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法不正确的是
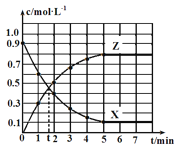
A. 2 min内,X的平均反应速率为0.25 mol·L-1·min-1
B. 第t min时,该反应达到平衡状态
C. 第5 min后,X的生成速率与Z的生成速率相等且保持不变
D. 5 min内,反应放出的热量为1.6Q kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】通过测定混合气中O2含量可计算已变质的Na2O2 (含Na2CO3) 纯度,实验装置如图(Q为弹性良好的气囊)。下列分析错误的是
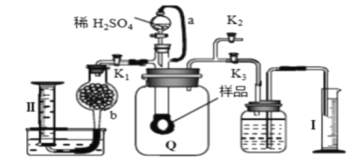
A. 干燥管b中装入碱石灰
B. Q气球中产生的气体主要成份O2、CO2
C. 测定气体总体积必须关闭K1、K2,打开K3
D. 读完气体总体积后,关闭K3,缓缓打开K1;可观察到Q气球慢慢缩小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com