
科目: 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 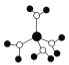 水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
水合铜离子的模型如图所示,1个水合铜离子中有4个配位键
B. 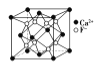 CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+
C.  H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
H原子的电子云图如图所示,H原子核外的大多数电子在原子核附近运动
D.  金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
金属Cu中Cu原子堆积模型如图所示,该金属晶体为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目: 来源: 题型:
【题目】已知高分子化合物I是轻工业生产的重要原料,其中一种生产合成路线如下:
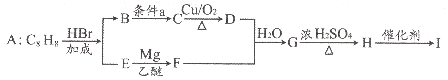
已知: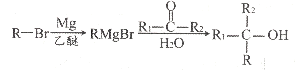
回答下列问题:
(1)A为芳香烃,A的化学名称是______。
(2)G→H、H→I的反应类型分别是______、______。
(3)若G结构为 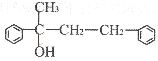
①请写出D的结构简式______。
②2由B生成C的化学方程式为__。
(4)C有多种同分异构体,其中属于酚类的同分异构体有_____种,写出其中具有四组核磁共振氢谱峰的一种结构简式_____。
(5)参考上述合成路线信息,写出以CH3-CH=CH2和CH3MgBr为原料(其它无机物任选)合成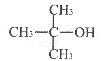 的合成路线图。_____
的合成路线图。_____
查看答案和解析>>
科目: 来源: 题型:
【题目】
黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。回答下列问题:
(1)CuFeS2中存在的化学键类型是_______。其组成的三种元素中电负性较强的是 _______。
(2)下列基态原子或离子的价层电子排布图正确的______。
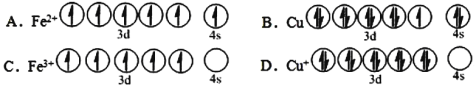
(3)在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①X分子的立体构型是____,中心原子杂化类型为____,属于_______(填“极性”或“非极性”)分子。
②X的沸点比水低的主要原因是___________。
(4)CuFeS2与氧气反应生成SO2,其结构式为![]() ,则SO2中共价键类型有_________。
,则SO2中共价键类型有_________。
(5)四方晶系CuFeS2晶胞结构如图所示。
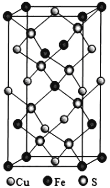
①Cu+的配位数为__________,
②已知:a=b=0.524 nm,c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是________gcm3(列出计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. O2、O3 是氧元素的同素异形体,性质都相似
B. 35Cl与37Cl-互为同位素
C. 乙二醇( ![]() ) 和甘油(
) 和甘油( ![]() )互为同系物
)互为同系物
D. CH3CHO 与![]() 互为同分异构体
互为同分异构体
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表达式错误的是
A. 甲烷的电子式:![]()
B. 碳原子的L层电子轨道表示式:![]()
C. 硫离子的核外电子排布式:1s22s22p63s23p6
D. 碳-12原子:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)0.3molNH3分子中所含氢原子数与___个H2O分子中所含氢原子数相等。
(2)含0.4molAl3+的Al2(SO4)3中所含的SO42-的物质的量是___。
(3)2.3gNa中含___mole-,在跟足量水反应中失去___mole-。
(4)如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化硫是大气的主要污染物之一。催化还原SO2不仅可以消除SO2的污染,还可以得到工业原料S。燃煤烟气中硫的回收反应为:2CO(g)+SO2(g) ![]() 2CO2(g)+S(l) △H。
2CO2(g)+S(l) △H。
(1)已知:2CO(g)+O2(g)===2CO2(g) △H1=-566.0kJ·mol-1
S(l)+O2(g)===SO2(g) △H2=-296.8 kJ·mol-1
则硫的回收反应的△H=___________ kJ·mol-1。
(2)其他条件相同、催化剂不同时,硫的回收反应中SO2的转化率随反应温度的变化如图所示。260℃时,___________(填“La2O3”、“NiO”或“TiO2”)的催化效率最高。La2O3和NiO作催化剂均可能使SO2的转化率达到很高,不考虑价格因素,选择La2O3的主要优点是___________。

(3)一定条件下,若在恒压密闭容器中发生硫的回收反应,SO2的平衡转化率与温度、压强的关系如图所示,则P1、P2、P3、P4由大到小的顺序为___________;某温度下,若在恒容密闭容器中,初始时c(CO)=2 a mol·L-1,c(SO2)= a mol·L-1,SO2的平衡转化率为80%,则该温度下反应的化学平衡常数为___________。
(4)某实验小组为探究烟气流速、温度对该反应的影响,用La2O3作催化剂,分别在两种不同烟气流量、不同温度下进行实验。实验结果显示:在260℃时,SO2的转化率随烟气流量增大而减小,其原因是___________;在380℃时,SO2的转化率随烟气流量增大而增大,其原因是___________。
(5)工业上常用Na2SO3溶液吸收烟气中的SO2,将烟气通入1.0 mol·L-1的N2SO3溶液,当溶液pH约为6时,吸收SO2的能力显著下降此时溶液中c(HSO3-)c︰(SO32-)=___________。(已知H2SO3的Ka1=1.5×10-2、Ka2=1.0×10-7)
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
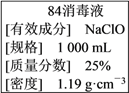
(1)消毒液”的物质的量浓度约为______ mol·L-1。
(2)某同学取100 mL 该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1。
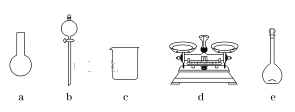
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是________(填字母)。
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用浓硫酸的体积为________ mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列物质:
①硫酸 ②盐酸 ③氯气 ④硫酸钡 ⑤酒精 ⑥铜 ⑦醋酸 ⑧氯化氢 ⑨蔗糖 ⑩氨气 CO2 NaHCO3 A l(OH)3 NaOH
(1)属于非电解质的为____(填序号,下同),属于弱电解质的为___,能导电的是___。
(2)写出下列反应的离子方程式
①NaHCO3溶于醋酸:______________________。
②过量CO2与NaOH溶液反应:______________。
③Cl2通入NaOH溶液中:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com