
科目: 来源: 题型:
【题目】一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L的气体。该合金中铝、铁的物质的量之比为( )
A. 1∶1 B. 2∶5 C. 3∶2 D. 3∶5
查看答案和解析>>
科目: 来源: 题型:
【题目】初中化学知识复习:
(1)按要求填空
HCOOH中C的化合价_________;K2MnO4中Mn的化合价________;
FeCl2的名称是_________;原子序数为18的元素的符号是________;
(2)按要求各写出一个化学方程式:
化合反应:_____________;分解反应:_____________;
置换反应:_____________;复分解反应:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】蛇纹石(含MgO、NiO、SiO2、Fe2O3、FeO等)因其外表青绿相问像蛇纹一样而得名。一种以蛇纹石为原料制取铁红和碱式碳酸镍[Ni3(OH)4CO34H2O]的流程如图:
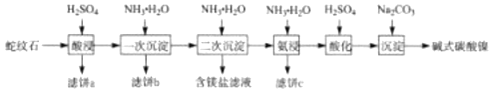
已知:Ⅰ.该实验温度下,不同pH时铁沉淀物成分及热分解产物:
pH | 铁沉淀物成分 | 热分解产物 |
2.5 | NH4Fe3(SO4)2(OH)6 | Fe2O3,SO2,SO3,NH3,O2,H2O |
3.5 | α-FeOOH | Fe2O3,H2O |
Ⅱ.部分金属离子沉淀的pH:
Mg2+ | Fe2+ | Ni2+ | |
开始沉淀的pH | 9.4 | 6.5 | 6.7 |
沉淀完全的pH | 12.4 | 9.7 | 9.5 |
Ⅲ.“氨浸“后所得溶液中主要成分为[Ni(NH3)6]2+,且存在[Ni(NH3)6]2+ Ni2++6NH3请回答:
(1)滤饼a的主要成分为___。
(2)滤饼b经洗涤、煅烧可得铁红。则“一次沉淀”时应控制pH=__(填“2.5或“3.5”),其原因为___。
(3)“氨浸”时生成[Ni(NH3)6]2+的离子方程式为___;此过程会同时加入 NH4HCO3,其目的为___。
(4)“沉淀”前须先”酸化”,用平衡移动原理解释其原因为__。
(5)实验室测得Ni3(OH)4CO34H2O(M=377)样品在空气中受热时样品失重率(失重率=固体样品损失的总质量/起始加入样品的质量×100%)与温度(T)的关系如图所示。

①200oC时所得固体的化学式为___。
②250~350oC之间反应的化学方程式为___。
(6)碱式碳酸镍可进一步转化制得镍氢电池。镍氢电池的工作原理为:Ni(OH)2+M![]() NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。
NiOOH+MH(M表示储氢金属或合金)。该电池充电过程中阴极的电极反应式为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】假如12C相对原子质量为24,以0.024kg12C所含的12C原子数为阿伏加德罗常数(NA),则下列说法正确的是( )
A.此时CO2的摩尔质量为88gmol﹣1
B.标准状况下44gCO2体积约为11.2L
C.44gCO2与28gCO含有相同数目的原子
D.NA个O2大约为6.02×1023个
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W 四种物质有如下相互转化关系(其中 Y、Z 为化合物,未列出反应条件)。

(1)若实验室经常用澄清石灰水来检验 X 的燃烧产物,W 的用途之一是计算机芯片,W 在周期表中的位置为 ___________,Y 的用途有 _________,写出Y与NaOH 溶液反应的离子方程式 _________。
(2)若 X、W 为日常生活中常见的两种金属,且 Y 常用作红色油漆和涂料,则该反应的化学方程式为___________。
(3)若 X 为淡黄色粉末,Y 为生活中常见液体,则:
①X 的电子式为 _______________,该反应的化学方程式为 ____________,生成的化合物中所含化学键类型有 ________________________。
② 若 7.8 克 X 物质完全反应,转移的电子数为 ___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钙是一种白色固体,难溶于水,常用作杀菌剂、防腐剂。
(1)化学实验小组选用如图装置(部分固定装置略)用钙和氧气制备过氧化钙。
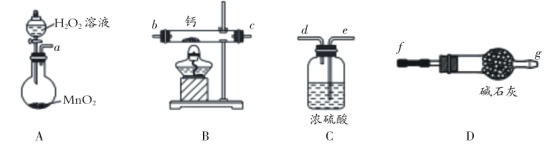
① 请选择装置,按气流方向连接顺序为 ___________(填仪器接口的字母编号)
② 实验室用A装置还可以制备 ______________ 等气体(至少两种)
③ 实验开始是先通氧气还是先点燃酒精灯?_________,原因是 ___________
(2)已知化学反应 Ca2+ + H2O2 + 2NH3 + 8H2O=CaO28H2O↓+ 2NH4+。在碱性环境中制取 CaO28H2O 的装置如图所示:
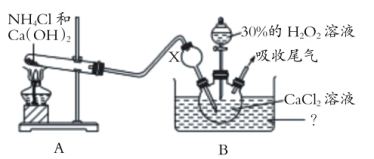
①写出 A 装置中发生反应的化学方程式:____________。
②为防止双氧水的分解并有利于 _________,装置 B 中应采用 ___________ 条件,装置 X 的作用是 ______________。
③ 反应结束后,经 _________、__________、低温烘干获得CaO28H2O。
查看答案和解析>>
科目: 来源: 题型:
【题目】用碱性氢氧燃料电池为电源进行电解的实验装置示意图如下所示。下列说法中正确的是
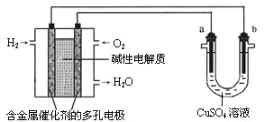
A. 燃料电池工作时,负极反应为:H2—2e-= 2H+
B. 若要实现铁上镀铜,则a极是铁,b极是铜
C. 若要实现电解精炼粗铜,则a极发生氧化反应, b极质量增加
D. 当a、b均是石墨时,当消耗H2 22.4L(标况)时,a极析出铜64g
查看答案和解析>>
科目: 来源: 题型:
【题目】100mL 0.3mol·L-1 Na2SO4溶液和50mL 0.2mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为(假设混合前后溶液体积变化忽略不计)( )
A.0.20mol·L-1B.0.25mol·L-1C.0.40mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是( )
A.1mol物质均约含有6.02×1023个分子B.6.02×1023个氢分子就是1mol H2
C.1gH2与1mol H2所含分子数相等D.1mol H2O与1molH2SO4的质量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】将镁铝合金溶于 100 mL 稀硝酸中,产生 1.12 L NO气体(标准状况),向反应后的溶液中加入 NaOH 溶液,产生沉淀情况如图所示。下列说法不正确的是

A.可以求出合金中镁铝的物质的量比为 1∶1B.可以求出硝酸的物质的量浓度
C.可以求出沉淀的最大质量为 3.21 克D.氢氧化钠溶液浓度为 3 mol / L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com