
科目: 来源: 题型:
【题目】化合物丙可由如下反应得到
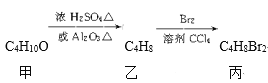
丙的结构简式不可能是( )
A. CH3CH(CH2Br)2B. (CH3)2CBrCH2Br
C. C2H5CHBrCH2BrD. CH3(CHBr)2CH3
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(夹持和净化装置省略)。仅用以下实验装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的液体 | b中的物质 | c中收集的气体 | d中的液体 |
A | 浓氨水 | 碱石灰 | NH3 | H2O |
B | 浓硝酸 | Cu | NO2 | H2O |
C | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
D | 稀硝酸 | Cu | NO | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年11月4日凌晨,福建泉州泉港区发生“碳九”泄露,对海洋环境造成污染,危害人类健康。“碳九”芳烃主要成分包含![]() (a)、
(a)、![]() (b)、
(b)、![]() (c)等,下列有关三种上述物质说法错误的是
(c)等,下列有关三种上述物质说法错误的是
A. a、b、c互为同分异构体 B. a、b、c均能与酸性高锰酸钾溶液反应
C. a中所有碳原子处于同一平面 D. 1molb最多能与4molH2发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料,Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,设计了如下装置简图:
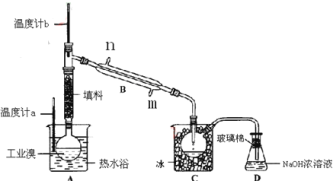
(1)装置B直形冷凝管进水方向______(填“Ⅱ”或“Ⅲ”),装置D的名称是_________。
(2)在A圆底烧瓶中加入一定量工业溴和2小片碎瓷片,加入碎瓷片的作用是_________;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是_______(填正确答案标号)。A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是_____________________。
(4)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:___________。
(5)装置C的作用:_____________________。装置D的作用是________________________。
(6)提纯液溴也要用到分液操作,分液漏斗在使用前须清洗干净并___________;用CCl4提取溴时,产物应该从分液漏斗的______________(填“上口倒出”或“下口放出”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:

下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
查看答案和解析>>
科目: 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。根据已知信息回答下列问题:
(1)已知:P和Cl2分两步反应生成1mol PCl5的热化学方程式:
P(s)+3/2Cl2(g)![]() PCl3(g) △H1=-306kJ/mol
PCl3(g) △H1=-306kJ/mol
Cl2(g)+PCl3(g)![]() PCl5(g) △H2=-93kJ/mol
PCl5(g) △H2=-93kJ/mol
①P和Cl2一步反应生成1molPCl5的△H3=______________ kJ/mol。
②工业上制备PCl5通常也分两步进行,通常将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5,原因是____________________________________________。
③PCl5与足量水充分反应,最终生成两种酸,其中一种是P的最高价含氧酸,其化学方程
式是________________________________________________________。
(2)反应PCl3(g)+Cl2(g)![]() PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
PCl5(g)在容积为10L的密闭容器中进行。起始时PCl3和Cl2均为0.2mol,反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
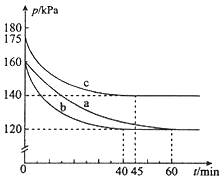
温馨提示:同温同容下的气体,压强之比就等于物质的量之比
①已知实验b平衡时气体的总物质的量为0.30mol,计算实验b反应开始至达到平衡时的反应速率v(PCl5)=_______________,PCl3的平衡转化率为__________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(PCl5)由小到大的次序为____(填实验序号);与实验a相比,c组改变的实验条件是升高温度,判断依据是_________,若α表示PCl3的平衡转化率,实验a和c的平衡转化率:αa______αc(填“<”或“>”);b组改变的实验条件是加入了催化剂,判断依据是_______________________________。
③用p0表示开始时总压强,p表示平衡时总压强,则α(表示PCl3的平衡转化率)的表达式为____(用p0,p表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】酯类化合物H是一种医药中间体,常用于防晒霜中紫外线的吸收剂。实验室由化合物A和E制备H的一种合成路线如下图:
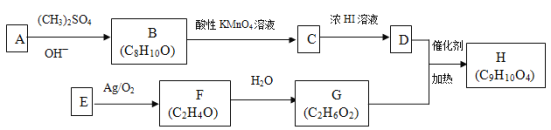
已知①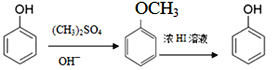
②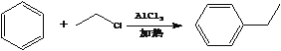
回答下列问题:
(1)经测定E的相对分子质量为28,常用来测定有机物相对分子质量的仪器为_______。F中只有一种化学环境的氢原子,其结构简式为_________________。
(2)(CH3)2SO4是一种酯,其名称为_________________。
(3)A能与Na2CO3溶液及浓溴水反应,且1molA最多可与2molBr2反应。核磁共振氢谱表明A的苯环上有四种不同化学环境的氢原子。A的结构简式为______________。C中含氧官能团的名称为_________。
(4)D+G→H的化学方程式为__________________。
(5)C的同分异构体中能同时满足下列条件的共有_____种(不含立体异构)。
①遇FeCl3溶液发生显色反应
②能发生水解反应
(6)参照上述合成路线,设计一条由![]() 和(CH3)3CCl为起始原料制备
和(CH3)3CCl为起始原料制备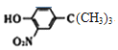 的合成路线(其他试剂任选); ________________________________________。
的合成路线(其他试剂任选); ________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是 。
(2)调节pH,实验记录如下:
实验 | pH | 现象 |
A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据实验现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:
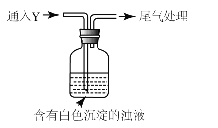
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。
查看答案和解析>>
科目: 来源: 题型:
【题目】早期发现的一种天然二十面体准晶颗粒由Cu、Fe、Al三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_________方法区分晶体、准晶体和非晶体。
(2)基态Cu原子最高能层符号_________,Cu位于周期表________区;新制备的Cu(OH)2可将丙醛(CH3CH2CHO)氧化成丙酸,而自身还原成Cu2O,Cu2O中Cu元素的化合价为_________。1mol丙醛分子中含有的σ键的数目为_________,丙酸的沸点明显高于丙醛,其主要原因是_________________。
(3)已知:
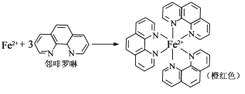
①Fe2+与邻啡罗啉形成的配合物(形成过程如图)中,配位体为_________________,配位原子数为__。
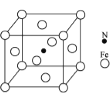
②铁能与氮形成一种磁性材料,其晶胞结构如图,则该磁性材料的化学式为___________。
③尿素(H2NCONH2)可用于制有机铁肥,主要代表有[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]。尿素分子中C、N原子的杂化方式分别是________、_________;与NO3-互为等电子体的一种化合物是_________(写化学式)。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为______,列式表示Al单质的密度_________________gcm﹣3(不必计算出结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列所示的物质间的转化均能实现的是( )
A.HCl(浓)![]() Cl2
Cl2![]() FeCl3(aq)
FeCl3(aq)
B.Al![]() Al2O3
Al2O3![]() Al(OH)3
Al(OH)3
C.NaCl(熔融)![]() Na
Na![]() NaOH
NaOH
D.N2![]() NO2
NO2![]() HNO3
HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com