
科目: 来源: 题型:
【题目】“文房四宝”湖笔、徽墨、宣纸和歙砚为中华传统文化之瑰宝。下列说法正确的是
A.制造毛笔时,将动物毫毛进行碱洗脱脂是为了增强笔头的吸水性
B.徽墨的主要成分是性质稳定的焦炭,故水墨字画能较长久地保存
C.宣纸的主要成分是碳纤维,其制造工艺促进了我国造纸术的发展
D.歙砚材质组云母的化学式用氧化物形式表示为:![]()

查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示2个甲分子反应生成1个丙分子和3个乙分子,下列判断不正确的是
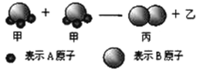
A.1个乙分子中含有2个A原子
B.该反应类型是分解反应
C.相对分子质量:Mr(甲)=Mr(乙)+Mr(丙)
D.该反应一定属于氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是__。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪色,有白色沉淀A产生。
针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:
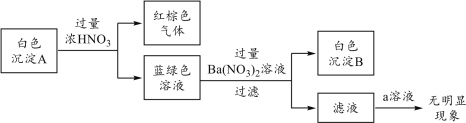
请回答:
①根据白色沉淀B是__(填化学式),判断沉淀A中一定存在CuSCN。
②仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:__。
③向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是__(填化学式)。
根据以上实验,证明A仅为CuSCN。
④进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_Cu2++_SCN-=_CuSCN↓+_(SCN)2
⑤结合上述过程以及Fe(SCN)3![]() Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__。
Fe3++3SCN-的平衡,分析(2)中溶液红色褪去的原因:__。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是__或__。
查看答案和解析>>
科目: 来源: 题型:
【题目】阿司匹林(化合物L)是人们熟知的解热镇痛药物。一种长效、缓释阿司匹林(化合物P)的合成路线如图所示:

已知:①HC![]() CH+RCOOH
CH+RCOOH![]() RCOOCH=CH2
RCOOCH=CH2
②RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
(1)B中的官能团是__。
(2)C的结构简式是__。
(3)D→E的反应类型是__。
(4)E→G的化学方程式是__。
(5)已知:H是芳香族化合物。在一定条件下2B→K+H2O,K的核磁共振氢谱只有一组峰。J→L的化学方程式是__。
(6)L在体内可较快转化为具有药效的J,而P与L相比,在体内能缓慢持续释放J。
①血液中J浓度过高能使人中毒,可静脉滴注NaHCO3溶液解毒。请用化学方程式解释NaHCO3的作用:__。
②下列说法正确的__(填字母)。
a.P中的酯基在体内可缓慢水解,逐渐释放出J
b.P在体内的水解产物中没有高分子化合物
c.将小分子药物引入到高分子中可以实现药物的缓释功能
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于离子的检验说法正确的是
A.向某溶液中滴入足量盐酸,如观察到无色无味的气体产生,且能使澄清石灰水变浑浊,即证明溶液中必定有![]()
B.向某无色溶液中加入BaCl2溶液,有白色沉淀出现,再加入稀盐酸,沉淀不消失,无法证明溶液一定含有![]()
C.向某无色溶液中加入少量稀氢氧化钠溶液后,用湿润的红色石蕊试纸靠近试管口,若试纸不变蓝,则说明该溶液中无![]()
D.如透过蓝色的钴玻璃能够观察到紫色火焰,则一定有钾元素,一定不含有钠元素
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、W有如图所示的转化关系(反应条件和部分其它反应物省略),则X、Y、Z可能是( )
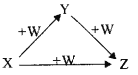
①Na、Na2O、Na2O2 ②AlCl3、Al(OH)3、NaAlO2 ③Fe、FeCl2、FeCl3 ④NaOH、Na2CO3、NaHCO3 ⑤C、CO、CO2
A. ①②③④⑤ B. ②④ C. ①③⑤ D. ①②④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列操作中,完全正确的一组是
①用试管夹夹持试管时,试管夹从试管底部往上套,夹在试管的中上部
②给盛有液体的体积超过![]() 容积的试管加热
容积的试管加热
③把鼻孔靠近容器口去闻气体的气味
④将试管平放,用纸槽往试管里送入固体粉末后,然后竖立试管
⑤加热坩埚要垫上石棉网
⑥将烧瓶放在桌上,用力塞紧塞子
⑦用坩埚钳夹取加热后的蒸发皿
⑧将滴管竖直伸入试管内滴加液体
⑨稀释浓硫酸时,应沿器壁缓缓地将水加入浓硫酸中
⑩用镊子从煤油中取出金属钠,再用小刀切一小块,然后将剩下的钠放回原瓶
A.①④⑦⑩B.①④⑤⑦⑩C.①④⑤⑦⑧⑩D.④⑤⑦⑩
查看答案和解析>>
科目: 来源: 题型:
【题目】AlN新型材料应用前景广泛,其制备与性质研究成为热点。
相关数据如下:
物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
Al | 660 | 2467 | >800 | AlN:>2000 (>1400升华) AlCl3:(>181升华) |
Mg | 649 | 1090 | >300 | Mg3N2:>800 |
(1)AlN的制备。
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是____________________。
Ⅱ.上述反应适宜的温度范围是______℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:__________________、_________和2Al + N2 ![]() 2AlN。
2AlN。
③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) 4Al(g) + 3O2(g) H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:______________________________________。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。
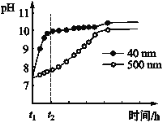
① AlN粉末水解的化学方程式是____________________________________。
② 解释t1-t2时间内两条曲线差异的可能原因:_______________________________。
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:
H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。总反应的化学方程式是________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。下列判断正确的是___________(填字母)。
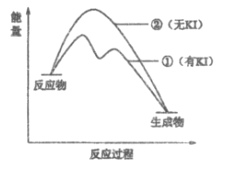
a. 加入KI后改变了反应的路径
b. 加入KI后改变了总反应的能量变化
c. H2O2+I-=H2O+IO-是放热反应
(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到___________,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. ________。以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。A试管加入CCl4,B试管不加CCl4,分别振荡、静置。观察到的现象是_____________。
(4)资料4:I-(aq)+I2(aq)![]() I3-(aq) K=640。
I3-(aq) K=640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:
微粒 | I- | I2 | I3- |
浓度/(mol·L-1) | 2.5×10-3 | a | 4.0×10-3 |
①a=__________。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫化物在自然界中的部分循环关系如图。
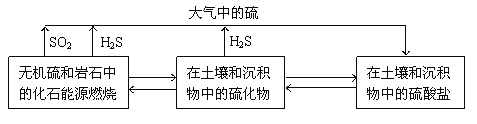
(1)H2S在空气中可以燃烧。
已知:2H2S(g)+O2(g)=2S(s)+2H2O(g) ΔH=-442.38kJ/mol
S(s)+O2(g)=SO2(g) ΔH=-297.04kJ/mol
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是____。
(2)SO2是大气污染物,海水具有良好的吸收SO2的能力,其过程如下。
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32-,SO32-可以被海水中的溶解氧氧化为SO42-。海水的pH会____(填“升高”、“不变”或“降低”)。
②为调整海水的pH,可加入新鲜的海水,使其中的HCO3-参与反应,其反应的离子方程式是____。
③在上述反应的同时需要大量鼓入空气,其原因是____。
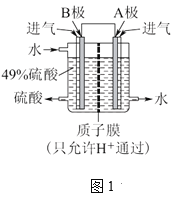
(3)某科研单位利用工业废气中的SO2来制取H2SO4。
①利用原电池原理,用SO2和O2来制备硫酸,装置如图1所示。B极的电极反应式是____。
②SO2经图2中的两个循环可分别得到S和H2SO4。下列说法正确的是____。
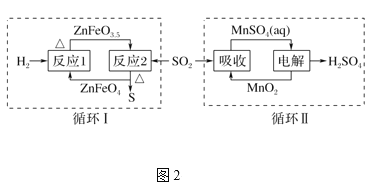
a.循环Ⅰ中,反应1中的氧化产物为ZnFeO3.5
b.循环Ⅰ中,反应2的化学方程式为SO2+4ZnFeO3.5![]() S+4ZnFeO4c.Mn可作为循环Ⅱ中电解过程中的阳极材料
S+4ZnFeO4c.Mn可作为循环Ⅱ中电解过程中的阳极材料
d.循环Ⅰ和循环Ⅱ中消耗同质量的SO2,理论上得到S和H2SO4的质量之比为16∶49
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com