
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)烃A在同温、同压下蒸气的密度是H2的35倍,其分子式为________。
(2)3—甲基—1一丁炔的结构简式为________
(3)![]() 的分子式为__________
的分子式为__________
(4)分子式为C8H10属于芳香烃的同分异构体共有______种,其中_______(结构简式)在苯环上的一氯取代产物有两种。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知实验室用浓硫酸和乙醇在一定温度下制备乙烯,某学习小组设计实验利用以下装置证明浓硫酸在该反应中的还原产物有SO2,并制备1,2-二溴乙烷。
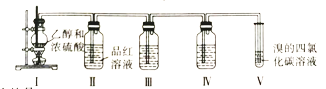
下列说法正确的是
A.浓硫酸在该反应中主要作用是催化剂、脱水剂
B.装置III、IV中的试剂依次为酸性高锰酸钾溶液、品红溶液
C.实验完毕后,采用萃取分液操作分离1,2-二溴乙烷
D.装置II中品红溶液褪色体现了SO2的还原性
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A C60和石墨 B 126C和136C C 冰醋酸和乙酸 D CH3CHO与![]() E 甲烷和十二烷 F 乙醇和乙二醇
E 甲烷和十二烷 F 乙醇和乙二醇
①互为同位素的是_________;
②互为同系物的是___________;
③互为同分异构体的是________;
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定量的有机物充分燃烧,产物先通入浓硫酸,浓硫酸增重5.4 g,然后通入足量澄清石灰水中,完全吸收后,经过滤得到20 g沉淀,则该有机物可能是( )
A. 乙醇B. 乙烯C. 甲酸甲酯D. 乙酸
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷、乙烯、乙醇都是重要的有机化合物。请回答下列问题:
(1)甲烷与氯气的第一步取代反应的化学方程式为____。
(2)把乙烯通入到溴的四氯化碳溶液中,充分振荡、静置,观察到溴的四氯化碳溶液褪色,写出该过程中发生反应的化学方程式___。
(3)下列几组物质中,互为同分异构体的是___,互为同位素的是___,互为同素异形体的是______,属于同一种物质的是__。
A.甲烷与新戊烷 B.氧气和臭氧 C.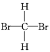 和
和![]() D.35Cl和37Cl E.CH3CH2OH和CH3OCH3
D.35Cl和37Cl E.CH3CH2OH和CH3OCH3
查看答案和解析>>
科目: 来源: 题型:
【题目】吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
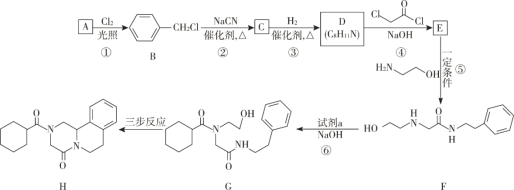
已知:I R-Cl+NaCN![]() R-CN+NaCl
R-CN+NaCl
ii 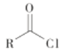 +R′-NH-R"+NaOH
+R′-NH-R"+NaOH![]()
 +NaCl+H2O(R、R′表示烃基,R"表示烃基或H)
+NaCl+H2O(R、R′表示烃基,R"表示烃基或H)
(1)A 属于芳香烃,其名称是________________________。
(2)步骤②的反应类型是_______________________________。
(3)B 的一种同分异构体,含苯环且核磁共振氢谱中出现三组峰,其结构简式为______________。
(4)③中 1mol C 理论上需要消耗__________________mol H2生成 D。
(5)④的化学方程式是 ________。
(6)F 中含氧官能团是 ![]() 和_______________________(填名称)。
和_______________________(填名称)。
(7)试剂 a 的结构简式是___________________。
(8)G→H 分为三步反应,J 中含有 3 个六元环,写出 I、J 的结构简式。
![]()
I:_____;J:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】羟基自由基(·OH,电中性,O 为-1 价)是一种活性含氧微粒。常温下,利用·OH 处理含苯酚废水,可将其转化为无毒的氧化物。
(1)·OH 的电子式为________。
(2) pH=3 时 Fe2+催化 H2O2 的分解过程中产生·OH 中间体,催化循环反应如下。将方程式 ii 补充完整。
i.Fe2++ H2O2+H+ = Fe3++ H2O +·OH
ii.___ + ___= ___+ O2↑+2H+
(3)已知:羟基自由基容易发生猝灭 2·OH = H2O2,从而活性降低.用 H2O2 分解产生的·OH 脱除苯酚,当其他条件不变时,不同温度下,苯酚的浓度随时间的变化如图 1 所示.0~20 min 时,温度从40℃上升到 50℃,反应速率基本不变的可能原因是________。
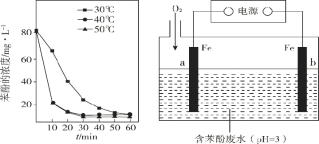
(4)利用电化学高级氧化技术可以在电解槽中持续产生·OH,使处理含苯酚废水更加高效,装置如图2所示。已知 a 极主要发生的反应是 O2 生成 H2O2,然后在电解液中产生·OH 并迅速与苯酚反应。
①b 极连接电源的________极(填“正”或“负”)。
②a 极的电极反应式为______。
③除电极反应外,电解液中主要发生的反应方程式有 ________ , _______。
查看答案和解析>>
科目: 来源: 题型:
【题目】卤素单质在碱性溶液中容易发生歧化反应,歧化的产物依反应温度的不同而不同。
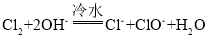 、
、![]()
下图为制取氯气、氯酸钾、次氯酸钠和检验氯气性质的微型实验装置:
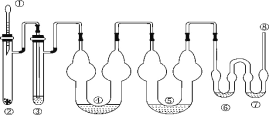
装置中盛装的药品如下:
①胶头滴管中装有 5 mL 浓盐酸;②微型具支试管中装有 1.5 g KMnO4;③微型具支试管中装有 2~3 mL 浓硫酸;④U 形反应管中装有 30% KOH 溶液;⑤U 形反应管中装有 2 mol·L-1 NaOH 溶液;⑥、⑦双 U 形反应管中分别装有 0.1 mol·L-1 KI-淀粉溶液和 KBr 溶液;⑧尾气出口用浸有 0.5 mol·L-1 Na2S2O3 溶液的棉花轻轻覆盖住
(1)检查整套装置气密性的方法是_________。
(2)为了使装置④⑤中的反应顺利完成,应该控制的反应条件分别为_______、_______。
(3)装置⑥⑦中能够观察到的实验现象分别是_________, _______。
(4)如果把装置⑥⑦中的试剂互换位置,则______(填“能”或“不能”)证明氧化性 Cl2>I2,理由是________。
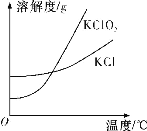
(5)已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置④所得溶液中提取氯酸钾晶体的实验操作是________。
(6)尾气处理时 Cl2 发生反应的离子方程式为_________。
(7)选择微型实验装置的优点有____________(任答两点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】碱式氯化铜[Cux(OH)yClz·mH2O]是重要的农药、医药中间体,还可用作木材防腐剂、饲料添加剂等.研究小组在实验室用某厂废铜渣(主要成分为 Cu、CuO,含少量 Fe3O4、Ni、Al2O3)制备碱式氯化铜的流程如下,回答下列问题:
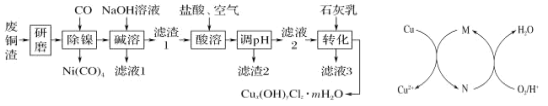
(1)“研磨”的目的为________。
(2)“碱溶”的目的为____________。
(3)“酸溶”时生成 Fe3+反应的离子方程式为_______;生成的 Fe3+对 Cu 发生的氧化反应的催化原理如上图所示。N 代表的物质为________(填化学式或离子符号)。
(4)“酸溶”时温度不能过高的理由为_________。
(5)若滤液 2 中 c(Fe3+)=4×10-8 mol/L,pH=4,则 Ksp[Fe(OH)3]=__________。
(6)为测定 Cux(OH)yClz·mH2O 的组成,进行如下操作:取样品 23.25 g,用适量酸溶解后配成 100mL 溶液;取 10.00 mL 溶液加入足量 AgNO3 溶液,生成 1.435 g 沉淀;另取 10.00 mL 溶液,用 1.000 mol/L的 EDTA 标准液滴定 Cu2+(Cu2+与 EDTA 以物质的量之比 1∶1 反应),滴定至终点时消耗标准液体积为 20.00 mL。
①溶解样品所用酸的化学式为________;
②最终确定该样品的化学式为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,将 0.10 mol·L-1 CH3COOH 溶液滴加到 10 mL 0.10 mol·L-1 NaOH 溶液中,lg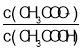 与pH 的关系如图所示,C 点坐标是(6,1.7)。下列说法不正确的是
与pH 的关系如图所示,C 点坐标是(6,1.7)。下列说法不正确的是
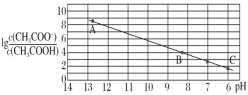
A.pH=7 时加入的醋酸溶液的体积大于 10 mL
B.C 点后继续加入醋酸溶液,水的电离程度减小
C.B 点存在 c(Na+)-c(CH3COO-)=(10-6-10-8)mol·L-1
D.Ka(CH3COOH)=10-4.3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com