
科目: 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、NO2吸收,原理如下图所示。
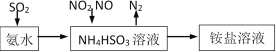
请写出NO2被吸收反应的离子方程式___________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:反应Ⅰ:2NO(g)+O2(g)==2NO2(g) ΔH1 =—113.0 kJ·molˉ1
反应Ⅱ:2SO2(g)+O2(g)==2SO3(1) ΔH2 =—288.4 kJ·molˉ1
反应Ⅲ:3NO2(g)+H2O(g)==2HNO3+NO(g) ΔH3 =—138.0 kJ·molˉ1
则反应NO2(g)+SO2(g)==NO(g)+SO3(1) ΔH4= _______________。
②已知TiO2催化尾气降解原理可表示为:2CO(g)+O2(g) ![]() 2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g)
2CO2(g) ΔH5; 2H2O(g)+4NO(g)+3O2(g) ![]() 4HNO3(g) ΔH6。
4HNO3(g) ΔH6。
在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图所示。请解释ts后NO降解率下降的可能原因_____________________。
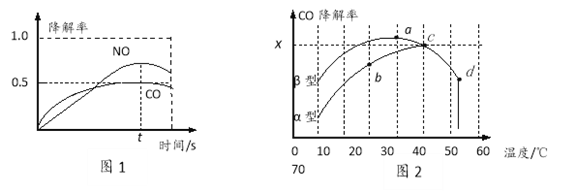
(3)沥青混凝土也可降解CO。如图为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L—1,求此温度下CO降解反应的平衡常数_______________。
②下列关于如图的叙述正确的是_________________
A.降解率由b点到c点随温度的升高而增大,可知CO降解反应的平衡常数Kb<Kc
B.相同温度下β型沥青混凝土中CO降解速率比α型要大
C.d点降解率出现突变的原因可能是温度升高后催化剂失效
③科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“![]() ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围_____________。
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式 ____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】红热的铁能与水蒸气反应,有氢气生成,现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
(1)写出铁在高温下与水蒸气反应的化学方程式:_____________________________
(2)干燥管C内盛放的药品可以是______或________(填化学式)。干燥管的________(填“m”或“n”)端与g导管相连接。
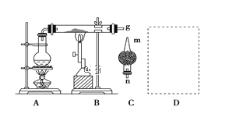
(3)在g处用试管收集氢气,简述用简单的方法检验收集到的气体是氢气的实验操作步骤和现象:_______________________________________
(4)停止反应后,待B处硬质玻璃管冷却后,取其中固体溶于过量的稀盐酸充分反应得溶液a,
①欲检验溶液中含有Fe3+,选用的试剂为溶液,现象是______________。
②该实验小组用上述试剂没有检测到Fe3+, 另取溶液a,加入少量酸性高锰酸钾溶液,高锰酸钾溶液褪色,溶液中反应的离子方程式为____________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组用如图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:
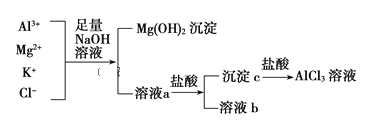
(1)写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:_________________。
(2)氢氧化钠溶液能否用氨水代替,为什么?___________________________。
(3)在溶液a中加入盐酸时需控制盐酸的量,为什么?___________。为此,改进方法是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】温度为T时,向体积为2 L的恒容密闭容器中加入足量铁粉和0.08 mol H2O(g),发生反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
Fe3O4(s)+4H2(g),一段时间后达平衡。t1时刻向容器中再充入一定量的H2,再次达平衡时H2的体积分数为20%。下列说法正确的是( )
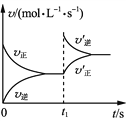
A. t1时刻充入H2,v′正、v′逆变化如右图
B. 第一次达平衡时,H2的体积分数小于20%
C. 温度为T时,起始向原容器中充入0.1 mol铁粉、0.04 mol H2O(g)、0.1 mol Fe3O4(s)、0.005 mol H2(g),反应向正反应方向进行
D. 温度为T时,向恒压容器中加入足量Fe3O4(s)和0.08 mol H2 (g),达平衡时H2(g)转化率为20%
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)1mol H2SO4中含有_____个硫原子,_____mol O。
(2)写出下列物质在水溶液中的电离方程式
HCl:_______________NaHSO4:____________________
(3)写出下列化学反应的方程式
呼吸面具中过氧化钠与二氧化碳反应的化学方程式_________________
氢氧化亚铁白色沉淀迅速变为灰绿色,最终变为红褐色的反应的化学方程式____________________
印刷电路板处理时铜与氯化铁溶液反应的离子方程式_______________________
(4)配平下列方程式:
_____I-+_____IO3-+ _____H+—_____I2+_____H2O
_____NH4ClO4——_____N2↑+_____O2↑+_____HCl+_____H2O
(5)用单线桥法或双线桥法表示该反应转移电子的方向和数目并填空:
Cu+4 HNO3(浓)= Cu(NO3)2+ 2 NO2↑+ 2H2O__________________
HNO3的作用是__________,发生氧化反应,氧化产物是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,向20mL 0.1mol·L-1的HA溶液中逐滴加入0.1mol·L-1的NaOH溶液,溶液中由水电离出H+浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积关系如图所示。下列说法不正确的是
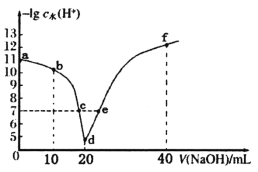
A.从a到d,HA的电离先促进再抑制
B.c、e两点溶液对应的pH=7
C.常温下,A-的水解平衡常数Kh约为1×10-9mol·L-1
D.f点的溶液呈碱性,粒子浓度之间存在:2c(HA)+c(A-)+c(H+)=c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是( )
A.Fe+2HCl=FeCl2+H2↑B.4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
C.I2+2NaClO3=2NaIO3+Cl2↑D.2HCl+Ca(ClO)2=2HClO+CaCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl22H2O晶体,加入___________________,调节pH=4过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl22H2O晶体。在空气中直接加热CuCl22H2O晶体得不到纯的无水CuCl2,原因是(用化学方程式表示)______________________________________________________________________ 。
(2) 由CuCl22H2O晶体得到纯的无水CuCl2的合理方法是________________________。
(3)某学习小组用“间接碘量法”测定含有CuCl22H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(已知:I2+2![]()
![]()
![]() +2I―)
+2I―)
①可选用___________作滴定指示剂,滴定终点的现象是_________________________ 。
②CuCl2溶液与KI反应的离子方程式为_____________________________________ 。(已知在相同条件下CuCl的溶解度大于CuI)
③该试样中CuCl22H2O的质量百分数为 __________________________________ 。
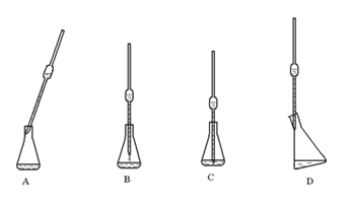
④如果试样是液体,用移液管移取时,下列使用正确的是 _____________________。
查看答案和解析>>
科目: 来源: 题型:
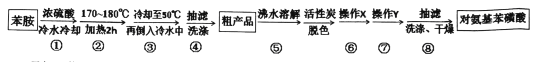
【题目】某兴趣小组以苯胺为原料,按以下反应原理和流程合成对氨基苯磺酸
![]() +H2SO4
+H2SO4 ![]()
![]() +H2O
+H2O
已知:苯胺是一种无色油状液体,微溶于水,易溶于乙醇,熔点-6.1℃,沸点184.4℃。对氨基苯磺酸是一种白色晶体,微溶于冷水,可溶于沸水,易溶于碱性溶液,不溶于乙醇。
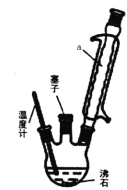
(1)下列操作或描述不正确的是________
A.步骤①浓硫酸要分批滴加且不断振荡,并在冰水中冷却目的是为防止苯胺的挥发或碳化
B.步骤③倒入冷水中后,若没有析出晶体,可用玻璃棒搅拌或加入晶种促进晶体析出
C.步骤②加热采用水浴加热,其优点是反应物受热均匀,便于控制温度
D.实验装置中温度计可以改变位置,也可使其水银球浸入在浴液中
(2)步骤②反应时如图所示装置中进行,其中仪器a的名称_________ 。步骤④中洗涤剂最好选择 ______ 洗涤沉淀的操作是______________。
A. 15%的乙醇 B.热水 C. 冷水 D.NaOH溶液
(3)苯胺与足量浓硫酸反应后,为验证苯胺是否完全反应,可取出几滴反应混合液滴到5-6mL10% NaOH溶液,若 _________现象则认为反应已基本完全。
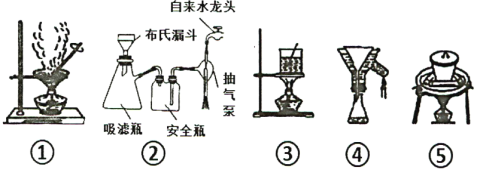
(4)步骤⑥中操作X为__________,实验有时需要将步骤⑤、⑦、⑧的操作重复多次,其目的是______________________。
(5)苯胺与浓硫酸混合时会反生副反应产生盐类物质,写出其反应化学方程式____。
(6)步骤⑤至⑧过程 ,下列装置肯定用不到的是___ ,若制得的晶体颗粒较小,分析可能的原因______(写出两点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】海洋植物如海带和海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
某化学兴趣小组将上述流程②、③设计成如下图所示操作。
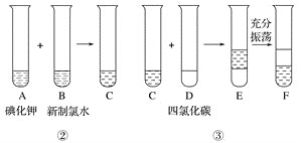
已知过程②发生反应的化学方程式为Cl2+2KI===2KCl+I2
回答下列问题:
(1)写出提取过程①、③中实验操作的名称:①____________,③____________。
(2)在灼烧过程中,使用到的实验仪器有酒精灯、____________、____________(除泥三角外)。
(3)F中下层液体的颜色为________色,上层液体中溶质的主要成分为____________。
(4)从F中得到固态碘还需进行的操作是_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com