
科目: 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大B. 平衡向正反应方向移动
C. D的体积分数变大D. a<c+d
查看答案和解析>>
科目: 来源: 题型:
【题目】将3.9 g Mg、Al合金溶于一定物质的量浓度的HCl溶液400 mL中,刚好完全反应,经检测合金和盐酸都无剩余,再向反应后的溶液中加入1mol/L的NaOH溶液后,生成沉淀。如果加入一定量的NaOH溶液至沉淀量最大时,溶液的总体积刚好为合金溶解时体积的两倍,假设完全反应(不考虑体积变化),试求:
(1)生成的沉淀的最大值是多少_________?
(2)原合金中Mg的质量百分含量_________(计算结果保留一位小数点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家研究发现药物肉桂硫胺(M)可能对2019-nCoV有效,是抗击新型冠状病毒潜在用药,以芳香烃A为原料,合成肉桂硫胺路线如图:
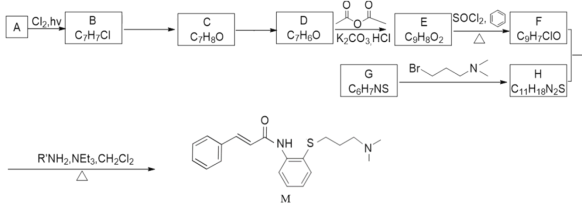
已知: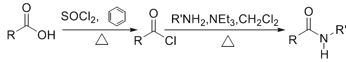
回答下列问题:
(1)A的名称为___。B→C的试剂和条件为__。
(2)C中含有的官能团名称为__。
(3)有机物D与新制的Cu(OH)2悬浊液加热煮沸产生砖红色沉淀的化学方程式是__。
(4)E反式结构简式为__,F最多有__个原子共平面。
(5)G→H的化学方程式为__,G→H的反应类型为__。
(6)J是E的同分异构体,满足下列条件的J的结构有___种;
①J能与溴水发生加成反应②J水解产物遇到FeCl3溶液显紫色
其中苯环上有两种化学环境的氢的结构简式为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品、用下图中的实验装置进行实验,证明过氧化钠可作供氧剂。

(1)A是制取CO2的装置。写出A中发生反应的方程式______________。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | _________ |
C | _________ | _________ |
D | _________ | _________ |
(3)写出过氧化钠与二氧化碳反应的化学方程式:__________。
(4)某课外小组为了验证Na2CO3和NaHCO3的稳定性,设计了如图所示的实验装置,你认为在试管B中应放的物质是_______,C、D两个烧杯中的溶液分别是______、_______,Na2CO3粉末中混有少量NaHCO3,除去杂质的方法(写方程式)________。
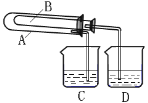
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁可与等物质的量的硫酸铵生成硫酸亚铁铵:(NH4)2SO4·FeSO4·6H2O,是一种复盐(又称摩尔盐)。一般亚铁盐在空气中易被氧气氧化,形成复盐后就比较稳定。与其他复盐一样,硫酸亚铁铵在水中的溶解度比组成它的每一种盐的溶解度都小,且几乎不溶于乙醇,利用这一性质可以制取硫酸亚铁铵晶体,三种盐的溶解度(单位为g/100gH2O)见下表:
温度℃ | FeSO4·7H2O | (NH4)2SO4 | (NH4)2SO4·FeSO4·6H2O |
10 | 20.0 | 73.0 | 17.2 |
20 | 26.5 | 75.4 | 21.6 |
30 | 32.9 | 78.0 | 28.1 |
实验用品:10%Na2CO3溶液、Fe屑、3molH2SO4、(NH4)2SO4、蒸馏水、无水乙醇。实验步骤流程如图所示:
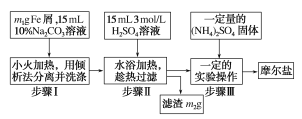
(1)步骤Ⅰ加入10%Na2CO3溶液的作用是__。
(2)下列情况适合倾析法的有__。
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤Ⅲ中加入(NH4)2SO4后要得到摩尔盐晶体,需要经过的实验操作包括加热蒸发、__、__。
(4)得到的晶体需要用乙醇洗涤的目的是__。
(5)已知摩尔盐晶体在100℃~110℃时分解,分解的产物中除固体外,还可能含有SO3(g)、SO2(g)及N2(g)。甲同学用如图所示装置设计实验,探究摩尔盐晶体加热分解时可能产生的气体产物。
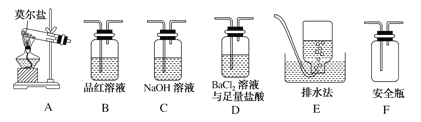
①甲同学的实验中,装置依次连接的合理顺序为:A→F→(____________)→(____________)→C→E。
②证明含有SO3的实验现象是__。
(6)为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成500mL溶液。通过测定NH4+设计实验装置如图所示。取25.00mL样品溶液进行该实验。
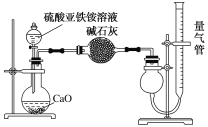
①该方案中量气管中最佳试剂是__。
a.水 b.饱和NaHCO3溶液 c.CCl4 d.饱和食盐水
②该方案中收集完气体并恢复至室温,读数前应进行的操作是__。
③设该样品中NH4+完全转化为NH3且忽略溶解损耗,测得NH3的体积为VL(已折算为标准状况下),则该摩尔盐样品中硫酸亚铁铵纯度为__(用含m、V的代数式表示,(NH4)2SO4·FeSO
查看答案和解析>>
科目: 来源: 题型:
【题目】对达到化学平衡状态的可逆反应:A+B ![]() C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )
C+D,若t0时增大压强,正、逆反应速率变化如图所示(v代表反应速率,t代表时间),下列有关A、B、C、D的状态叙述中正确的是( )

A.A、B、C是气体,D不是气体
B.A、B是气体,C、D有一种是气体
C.C、D是气体,A、B有一种是气体
D.C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题
(1)实验室可用K2Cr2O7固体与浓盐酸反应制备氯气,发生反应的化学方程式为K2Cr2O7 +14HCl(浓)=3Cl2↑+2CrCl3 +2KCl+7H2O,当转移0.6mole-时被氧化的HCl为_____mol
(2)同温同压下,相同物质的量的SO2气体和SO3气体,其分子数之比为_________,密度之比为_________
(3)①向溴化钠溶液中通入适量的氯气,产生的现象是________,反应的化学方程式是_________;
②Cl2、Br2、I2三种单质氧化性强弱的关系是______。
③下列海产品中可以考虑用于工业上大量地提取碘的是________。
①贝壳 ②紫菜 ③鱼 ④海带
(4)将相同质量的镁条分别在:①氧气;②空气;③氮气;④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序是_____(填序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制。
(1)基态硫原子价层电子的轨道表达式![]() 电子排布图
电子排布图![]() 为__,基态镍原子中核外电子占据最高能层的符号为__。
为__,基态镍原子中核外电子占据最高能层的符号为__。
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为__晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为__,写出与配体互为等电子体的阴离子__![]() 任写一种
任写一种![]() 。
。
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱__>__![]() 填化学式
填化学式![]() ,理由是__。
,理由是__。
(4)H2S的键角__填“大于”“小于”“等于”)H2O的键角,请从电负性的角度说明理由__。
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的__空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为__g/cm3(只列出计算式![]() 。
。
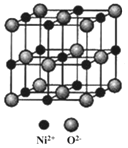
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.钠与水反应:Na+H2O=Na++OH-+H2↑
B.氯气与水反应: Cl2+H2O=2H++Cl-+ClO-
C.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O
D.将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】汽车尾气排放的CO、NOx等气体是大气污染的主要来源,NOx也是雾天气的主要成因之一。
(1)科学家研究利用催化技术将尾气中有害的NO和CO转变成无污染的气体,已知:
N2(g)+O2(g)=2NO(g) ΔH1=+180.5kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221.0kJ·mol-1
CO2(g)=C(s)+O2(g) ΔH3=+393.5kJ·mol-1
①C(s)的燃烧热ΔH=__。
②请写出CO和NO生成无污染气体的热化学方程式为__。
(2)往1L恒容密闭容器中充入一定量的NO2,在三种不同条件下发生反应:2NO2(g)![]() 2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
2NO(g)+O2(g),实验测得NO2的浓度随时间的变化如下表(均使用了催化剂,不考虑生成N2O4)。
时间(min) 浓度(mol/L) 实验序号/温度 | 0 | 10 | 20 | 30 | 40 | 50 |
实验1/800℃ | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
实验2/800℃ | 1.00 | 0.70 | 0.50 | 0.50 | 0.50 | 0.50 |
实验3/850℃ | 1.00 | 0.50 | 0.40 | 0.35 | 0.35 | 0.35 |
①下列说法正确的是__。
A.实验2容器内压强比实验1的小
B.在0→10mim内实验2的反应速率υ(O2)=0.015mol/(L·min)
C.实验1比实验3的平衡常数大
D.实验2使用了比实验1效率更高的催化剂
②不能判断反应已达到化学平衡状态的是__。
A.容器内的气体压强不变
B.2v正(NO2)=v逆(O2)
C.气体的平均相对分子质量保持不变
D.NO2和NO的浓度比保持不变
③已知容器内的起始压强为P0kPa,在800℃温度下该反应的平衡常数Kp=__(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡后,再向容器中加入NO2和NO各2mol,平衡将__(填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)。
(3)若将NO2与O2通入甲中设计成如图所示装置,D电极上有红色物质析出,则A电极处通入的气体为__(填化学式);A电极的电极反应式为__。
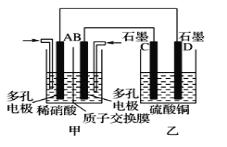
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com