
【题目】按要求回答下列问题
(1)实验室可用K2Cr2O7固体与浓盐酸反应制备氯气,发生反应的化学方程式为K2Cr2O7 +14HCl(浓)=3Cl2↑+2CrCl3 +2KCl+7H2O,当转移0.6mole-时被氧化的HCl为_____mol
(2)同温同压下,相同物质的量的SO2气体和SO3气体,其分子数之比为_________,密度之比为_________
(3)①向溴化钠溶液中通入适量的氯气,产生的现象是________,反应的化学方程式是_________;
②Cl2、Br2、I2三种单质氧化性强弱的关系是______。
③下列海产品中可以考虑用于工业上大量地提取碘的是________。
①贝壳 ②紫菜 ③鱼 ④海带
(4)将相同质量的镁条分别在:①氧气;②空气;③氮气;④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序是_____(填序号)。
【答案】0.6mol 1:1 4:5 溶液由无色变为橙色 Cl2+2NaBr=Br2+2NaCl Cl2>Br2>I2 ④ ③<②<①<④
【解析】
(1)先分析方程式中转移电子与发生氧化反应消耗HCl的关系,然后计算转移0.6mole-时被氧化的HCl的物质的量;
(2)根据n=![]() 及
及![]() 计算;
计算;
(3)①活动性强的可以把活动性弱的置换出来,根据Br2的水溶液显橙色分析;
②根据同一主族的元素性质变化规律分析;
③根据海产品的成分分析;
(4)根据题意结合化学反应的方程式,可以使各个产物在镁原子个数相同的情况下来比较质量的大小。
(1)在反应K2Cr2O7 +14HCl(浓)=3Cl2↑+2CrCl3 +2KCl+7H2O中,每转移6mol电子,会有6molHCl被氧化产生Cl2,则当转移0.6mole-时被氧化的HCl的物质的量为0.6mol;
(2)根据物质的量与微粒数目关系式n=![]() 可知:气体的分子数的比等于气体的物质的量的比。所以同温同压下,相同物质的量的SO2气体和SO3气体,其分子数之比为1:1;在同温同压下,气体摩尔体积相同,根据气体的密度定义式
可知:气体的分子数的比等于气体的物质的量的比。所以同温同压下,相同物质的量的SO2气体和SO3气体,其分子数之比为1:1;在同温同压下,气体摩尔体积相同,根据气体的密度定义式![]() 可知:气体的密度与气体的摩尔质量成正比,所以在同温同压下, SO2气体和SO3气体的密度比ρ(SO2):ρ(SO3)=64g/mol:80g/mol=4:5;
可知:气体的密度与气体的摩尔质量成正比,所以在同温同压下, SO2气体和SO3气体的密度比ρ(SO2):ρ(SO3)=64g/mol:80g/mol=4:5;
(3)①由于活动性Cl2>Br2,所以向溴化钠溶液中通入适量的氯气,会发生反应:Cl2+2NaBr=Br2+2NaCl,反应后产生的Br2的水溶液显橙色,因此看到的现象是溶液由无色变为橙色;
②同一主族的元素,从上到下元素的非金属性逐渐减弱,单质的氧化性逐渐减弱,所以Cl2、Br2、I2三种单质氧化性强弱的关系是Cl2>Br2>I2;
③①贝壳主要成分为碳酸钙,①不符合题意;
②紫菜主要成分为蛋白质、维生素,②不符合题意;
③鱼主要成分为蛋白质,③不符合题意;
④海带含有丰富的碘元素,主要以碘化钾的形式存在,④符合题意;
故合理选项是④;
(4)Mg燃烧的有关反应方程式为:2Mg+O2 ![]() 2MgO; 3Mg+N2
2MgO; 3Mg+N2![]() Mg3N2; 2Mg+CO2
Mg3N2; 2Mg+CO2![]() 2MgO+C,可假设镁的物质的量是1mol,比较Mg燃烧后生成的固体增加的质量;1molMg在O2中燃烧质量增加1molO原子的质量16g;在N2中燃烧质量增加
2MgO+C,可假设镁的物质的量是1mol,比较Mg燃烧后生成的固体增加的质量;1molMg在O2中燃烧质量增加1molO原子的质量16g;在N2中燃烧质量增加![]() molN2的质量
molN2的质量![]() g;在空气中燃烧产物既有MgO、也有Mg3N2,所以增加的质量在
g;在空气中燃烧产物既有MgO、也有Mg3N2,所以增加的质量在![]() g~16g之间;在CO2中燃烧质量增加1molO和0.5molC原子的质量,16g+6g=22g,可见等质量的Mg在四种情况下质量增加由小到大的顺序是③氮气<②空气<①氧气<④二氧化碳,Mg的质量相等,增加的质量越大,则反应后得到的固体质量越大,所以将相同质量的镁条分别在:①氧气;②空气;③氮气;④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序是③<②<①<④。
g~16g之间;在CO2中燃烧质量增加1molO和0.5molC原子的质量,16g+6g=22g,可见等质量的Mg在四种情况下质量增加由小到大的顺序是③氮气<②空气<①氧气<④二氧化碳,Mg的质量相等,增加的质量越大,则反应后得到的固体质量越大,所以将相同质量的镁条分别在:①氧气;②空气;③氮气;④二氧化碳中完全燃烧,燃烧后所得固体产物的质量由小到大的顺序是③<②<①<④。


科目:高中化学 来源: 题型:
【题目】实验室可用如下方法制取Cl2,根据相关信息,回答下列问题:
(1)在该反应中,HCl表现的性质有______、________.
①MnO2 +4HCl(浓)![]() Cl2↑+ MnCl2+ 2H2O
Cl2↑+ MnCl2+ 2H2O
(2)若反应中有0.1mol的氧化剂被还原,则被氧化的物质为________(填化学式),被氧化物质的物质的量为 _____,同时转移电子数为_____(用NA表示)。
(3)将(2)生成的氯气与 0.2mol H2 完全反应,生成的气体在标准状况下所占体积为_________,将此产物溶于水配成100mL溶液,此溶液的物质的量浓度为_______。
(4)②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③三个反应中电子转移的数目之比为____。
(5)已知反应4HCl(g)+O2  2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______。
2Cl2+2H2O(g),该反应也能制得氯气,则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为_______。
(6)将不纯的NaOH样品2.50 g(样品含少量Na2CO3和水),放入50.0 mL 2.00mol/L盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40.0 mL 1.00 mol/L的NaOH溶液。蒸发中和后的溶液,最终得到固体的质量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
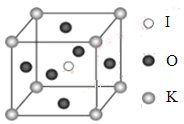
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列有关叙述正确的是( )
A.0.1molC4H4(键线式:![]() )含共价键数目为0.4NA
)含共价键数目为0.4NA
B.30g冰醋酸和乳酸(C3H6O3)的混合物中含氢原子的数目为2NA
C.常温下,0.5mol/L的氨水溶液中氢氧根数目小于0.5NA
D.6.4g铜粉与3.2g硫粉混合隔绝空气加热充分反应,转移电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.9 g Mg、Al合金溶于一定物质的量浓度的HCl溶液400 mL中,刚好完全反应,经检测合金和盐酸都无剩余,再向反应后的溶液中加入1mol/L的NaOH溶液后,生成沉淀。如果加入一定量的NaOH溶液至沉淀量最大时,溶液的总体积刚好为合金溶解时体积的两倍,假设完全反应(不考虑体积变化),试求:
(1)生成的沉淀的最大值是多少_________?
(2)原合金中Mg的质量百分含量_________(计算结果保留一位小数点)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.N2电子式为![]()
B.Cl-的结构示意图为![]()
C.CO2的结构式为O—C—O
D.氯化镁的电子式:Mg2+[C![]() ]
]![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠常用作漂白剂、杀菌剂、消毒剂,能与水和二氧化碳等物质发生反应,保存不当时容易变质。某实验小组以过氧化钠为研究对象进行了如下实验。
(1)探究一包Na2O2样品是否已经变质:取少量样品,加水将其溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该实验小组为了粗略测定过氧化钠的质量分数,称取了m g样品,并设计用下图装置来测定过氧化钠的质量分数。
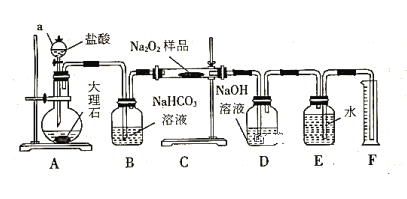
①装置D的作用是_________________________________;
②写出装置C中发生主要反应的化学方程式____________;
③读出量筒内水的体积后,将其折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com