
科目: 来源: 题型:
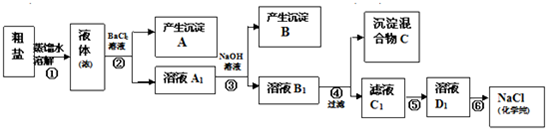
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 序号 | 实验设计 | 实验观察(主要现象) | 离子方程式 | 解释与结论 |
| ① | 在铁粉中滴 入稀硫酸 |
铁粉溶解,溶液由无 色变成浅绿色,有无 色无味的气体生成 |
Fe+2H+=H2↑+Fe2+ |
Fe具有还原性 |
② |
氯化亚铁溶液中滴入KSCN溶液,再加入氯水 | 滴入KSCN溶液无明 显变化,加入氯水立 即变成血红色 |
2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(KSCN)3 2Fe2++Cl2=2Fe3++2Cl-Fe3++3SCN-=Fe(KSCN)3 |
Fe2+具有还原性 Fe2+具有还原性 |
| ③ | 氯化亚铁溶液加 入锌片 |
锌片溶解,析出铁,溶液从浅绿色变为无色 锌片溶解,析出铁,溶液从浅绿色变为无色 |
Fe2++Zn=Fe+Zn2+ | Fe2+具有氧化性 Fe2+具有氧化性 |
④ |
在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片) 在氯化铁溶液中加入KSCN溶液,再加入足量Cu片(或铁粉或锌片) |
加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失 加入KSCN溶液出现血红色,加入足量Cu片(或铁粉或锌片)后血红色消失 |
2Fe3++Cu=2Fe2++Cu2+或2Fe3++Fe=3Fe2+或2Fe3++Zn=2Fe2++Zn 2+或 2Fe3++3Zn=2Fe+3 Zn 2+ 2Fe3++Cu=2Fe2++Cu2+或2Fe3++Fe=3Fe2+或2Fe3++Zn=2Fe2++Zn 2+或 2Fe3++3Zn=2Fe+3 Zn 2+ |
Fe3+具有氧化性 |
查看答案和解析>>
科目: 来源: 题型:
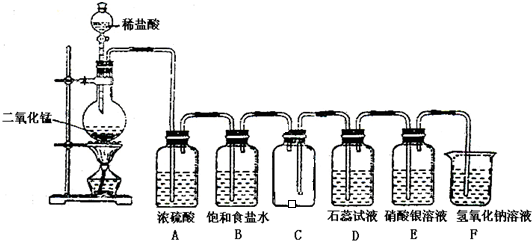
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 无明显现象 |
| ② | B+D | 有无色无味气体放出 |
| ③ | C+B | 有白色沉淀生成 |
| ④ | A+D | 有白色沉淀生成 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
下表为各物质中所含的杂质以及除去这些杂质选用的试剂或操作方法,正确的一组是( )
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com