
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:阅读理解
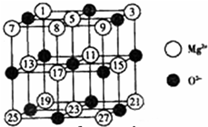 (2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
(2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.| 氧化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
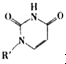 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: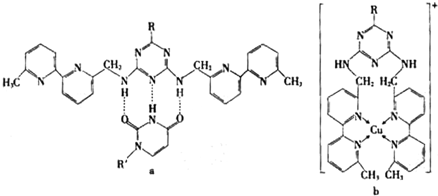
查看答案和解析>>
科目: 来源: 题型:阅读理解


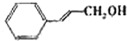
| 醇 | 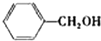 |
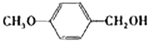 |
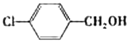 |
| 反应时间/h | 2.5 | 2.5 | 2.5 |
| 醛的产率/% | 95 | 96 | 94 |
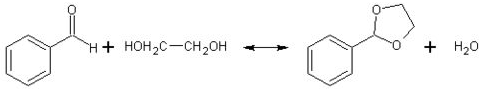
| 醇 | 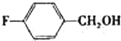 |
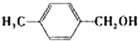 |
 |
| 反应时间/h | 3.0 | 3.0 | 15.0 |
| 醛的产率/% | 95 | 92 | 40 |
| 水浴加热 |
| 水浴加热 |
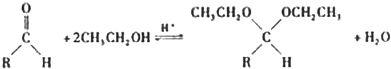

查看答案和解析>>
科目: 来源: 题型:





查看答案和解析>>
科目: 来源: 题型:
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
 2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为| 4 |
| 7 |
 N2(g)+3H2(g)的平衡常数.
N2(g)+3H2(g)的平衡常数.查看答案和解析>>
科目: 来源: 题型:

| ||
| ||
查看答案和解析>>
科目: 来源: 题型:阅读理解
| 矿石名称 | 黄铜矿 | 斑铜矿 | 辉铜矿 | 孔雀石 |
| 主要成分 | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3?Cu(OH)2 |
| ||
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铜绿的主成分是碱酸铜 | 可用稀盐酸除铜器表面的铜绿 | Ⅰ对;Ⅱ对;有 |
| B | 铜表易形成致密的氧化膜 | 铜容器可以盛放浓硫酸 | Ⅰ对;Ⅱ对;有 |
| C | 铁比铜活泼 | 例在铜板上的铁钉在潮湿空气中不易生锈 | Ⅰ对;Ⅱ对;有 |
| D | 蓝色硫酸铜晶体受热转化为白色硫酸铜粉末是物理变化 | 硫酸铜溶液可用作游泳池的消毒剂 | Ⅰ错;Ⅱ对;无 |
查看答案和解析>>
科目: 来源: 题型:
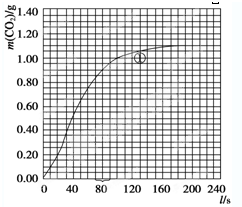
| 实验编号 | T/K | 大理石规格 | HNO3浓度 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00mol/L | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 ③ ③ 探究温度对该反应速率的影响;(Ⅲ)实验①和 ④ ④ 探究大理石规格 (粗、细)对该反应速率的影响. |
| ② | ||||
| ③ | ||||
| ④ |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com