
科目: 来源: 题型:
【题目】下图是新型镁一锂双离子二次电池。下列关于该电池的说法正确的是
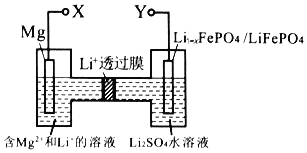
A.放电时,Li+由右向左移动
B.放电时,正极的电极反应式为Li1-x-FePO4+xLi++xe-=LiFePO4
C.充电时,外加电源的负极与Y相连
D.充电时,导线上每通过1mol e-,左室溶液质量减轻12g
查看答案和解析>>
科目: 来源: 题型:
【题目】为研究沉淀的生成及其转化,某小组进行如图实验。关于该实验的分析不正确的是
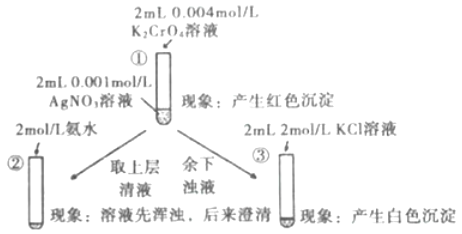
A.①浊液中存在平衡:Ag2CrO4(s)2Ag+(aq)+CrO42-(aq)
B.②中溶液变澄清的原因:AgOH+2NH3·H2O=[Ag(NH3)2]OH+2H2O
C.③中颜色变化说明有AgCl生成
D.该实验可以证明AgCl比Ag2CrO4更难溶
查看答案和解析>>
科目: 来源: 题型:
【题目】太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、钴、硼、镓、硒等。回答下列问题:
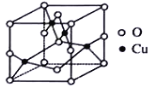
(1)基态二价铜离子的电子排布式为______,已知高温下Cu2O比CuO更稳定,试从核外电子排布角度解释______。
(2)铜的某种氧化物晶胞如图,该晶胞中阴离子的个数为_________。
(3)铜与(SCN)2反应生成Cu(SCN)2,中心体为___________,HSCN结构有两种,硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的原因是_________。
(4)BF3能与NH3反应生成BF3·NH3。B与N之间形成配位键,氮原子提供_____,第二周期元素中,电离能介于B和N之间的元素有_______个。
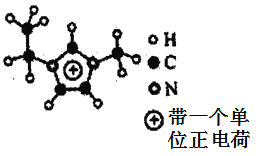
(5)如图EMIM+离子中,碳原子的杂化方式是___________。分子中的大π键可用符号πnm表示,其中n代表参与形成大π键的原子数,m代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则EMM+离子中的大π键应表示为___________。
(6)如图六方氮化硼晶体结构与石墨晶体相似,则六方氮化硼晶体中层间的相互作用为___________。六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构、硬度与金刚石相似,其晶胞如图,晶胞边长为361.5pm,立方氮化硼的密度是___________g·cm-3(只列算式,![]() 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。

查看答案和解析>>
科目: 来源: 题型:
【题目】PbCO3可用于油漆、陶瓷和玻璃等工业。由方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2)制备PbCO3的流程如下:
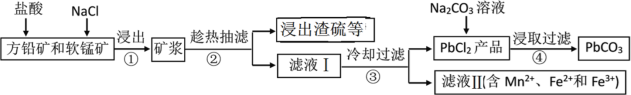
已知:PbCl2难溶于冷水和乙醇,易溶于热水;各物质的溶度积见表。试回答下列问题:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | PbCl2 | PbS | PbCO3 |
Ksp | 2×10-13 | 8.0×10-16 | 1×10-38 | 1.6×10-5 | 8.0×10-28 | 7.4×10-14 |
(1)PbCO3的名称是________。
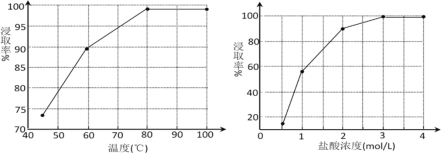
(2)步骤①中MnO2的作用是________,根据下图分析过程①的最佳反应条件是_________。
(3)步骤②趁热抽滤的原因是___________________。
(4)步骤③洗涤用的试剂是____________。
(5)将滤液Ⅱ先酸化,然后加入MnO2,反应的离子方程式为________;若反应后![]() ,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________
,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________![]() 时表示Fe3+已沉淀完全]。
时表示Fe3+已沉淀完全]。
(6)步骤④反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是物质间发生化学反应的颜色变化,下表选项中的物质对应正确的是( )
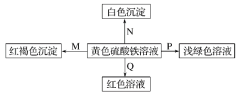
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | 石蕊溶液 |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
D | Na2O2 | MgCl2 | Fe | 石蕊溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物Ⅰ( )是一种新型感光高分子化合物,工业上合成它的一种路线图如下,图中C、D也是高分子化合物且D具有强的亲水性,反应①中C2H2发生了加成反应,烃E的质谱图中质荷比最大值为92,G能发生银镜反应。又知同一个碳原子上若连接有2个或3个羟基时,自动脱去一个水分子。
)是一种新型感光高分子化合物,工业上合成它的一种路线图如下,图中C、D也是高分子化合物且D具有强的亲水性,反应①中C2H2发生了加成反应,烃E的质谱图中质荷比最大值为92,G能发生银镜反应。又知同一个碳原子上若连接有2个或3个羟基时,自动脱去一个水分子。

(1)A的结构简式为____________,E的名称是___________________,③的反应类型是________。
(2)B中官能团的名称是____________,C的结构简式为______________。
(3)写出反应④的化学方程式:_________________。
(4)X是H的芳香族同分异构体,X具有如下性质,能发生银镜反应且1molX与足量银氨溶液反应时可得到4molAg,则X共有______________种,写出一种核磁共振氢谱有4组峰的同分异构体的结构简式_______________。
(5)以乙苯、乙炔为基本原料制备苯乙酸乙烯酯(![]() ),写出其合成路线图:_____________。
),写出其合成路线图:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,还可利用CO2据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。
(1)利用CO2和H2反应合成甲醇的原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)/% | 10 | 20 | 30 | 4b | 50 | 60 | 70 | 80 | 90 |
CH3OH的产率 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为________催化效果最佳。
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)
CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)
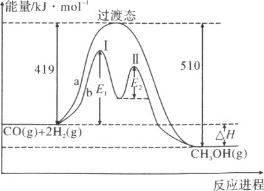
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)①在1L的恒定密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示,则压强P2________P1(填“>”、“<”或“=”);平衡由A点移至C点、D点移至B点,分别可采取的具体措施为________、________;在c点时,CO的转化率为________。
②甲和乙两个恒容密闭容器的体积相同,向甲中加入1molCO和2molH2,向乙中加入2molCO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)________2P(L);平衡常数:K(M)________K(L)。(填“>”、“<”或“=”)

(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳的捕集和转化是科学研究中的热点问题。我国科研人员提出了以Ni/Al2O3为催化剂,由 CO2(g)和H2(g)转化为CH4(g)和H2O(g)的反应历程,其示意图如下:
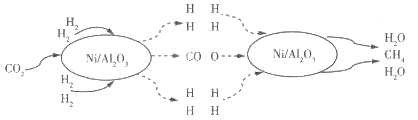
(1)该可逆反应的化学方程式为_________。使用催化剂Ni/Al2O3_________ (填“能”或“不能”)提髙CO2的平衡转化率。
(2)300℃下,在一恒容密闭容器中充入一定量的CO2与H2,发生上述反应,一段时间后反应达平衡,若其他条件不变,温度从300℃升至500℃,反应重新达到平衡时,H2的体积分数增加。下列说法错误的是_________(填标号)。
A.该反应的![]()
B.平衡常数大小:![]()
C.300℃下,减小![]() 的值,
的值,![]() 的平衡转化率升高
的平衡转化率升高
D.反应达到平衡时化![]()
(3)在一定条件下,反应体系中CO2的平衡转化率a( CO2)与L和X的关系如图所示,L和X表示温度或压强。
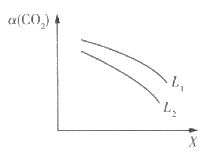
①X表示的物理量是___________。
②L1_____________L2(填“<”“>”),判断理由是______________________________________。
(4)向1 L恒容密闭容器中加入4.0 mol H2(g),1.0 mol CO2,控制条件(催化剂为 Ni/AI2O3、温度为T1)使之发生上述反应,测得容器内气体的压强随时间的变化如图所示。
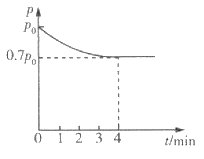
①4 min时CO2的转化率为___________。
②T1温度下该反应的化学平衡常数为___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,用0.10 moI/LNaOH溶液滴定0.10 mol/LHA溶液,滴定曲线如图a所示,混合溶液的pH与离子浓度变化的关系如图b所示。下列叙述错误的是
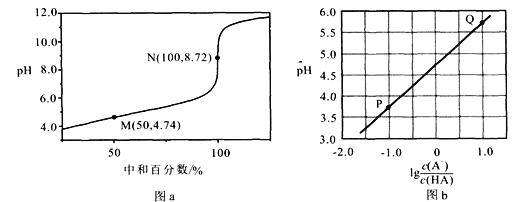
A. Ka(HA)的数量级为10-5
B. N点,![]()
C. P—Q过程中,水的电离程度逐渐增大
D. 当滴定至溶液呈中性时,c(A-)>c(HA)
查看答案和解析>>
科目: 来源: 题型:
【题目】氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
HF(aq)+OH—(aq)=F—(aq)+H2O(l)△H=—67.7 kJ·mol—1
②H+(aq)+OH—(aq)=H2O(l)△H=—57.3 kJ·mol—1
在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
A. 氢氟酸的电离方程式及热效应可表示为HF(aq)=H+(aq) +F(aq) △H=+10.4kJ·mol—1
B. 当V=20时,溶液中:c(OH—)=c(HF) +c(H+)
C. 当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1
D. 当V>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com