粗盐常含有少量Ca
2+、Mg
2+、SO
42-以及泥沙等杂质,实验室提纯NaCl的流程如下:(加入的试剂稍过量)
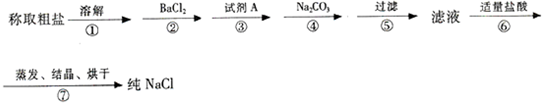
(1)步骤③中加入的试剂A是
NaOH
NaOH
(填化学式),除去的离子是
Mg2+
Mg2+
,试剂A稍过量的目的是
使Mg2+沉淀完全
使Mg2+沉淀完全
,反应的离子方程式
Mg2++2OH-═Mg(OH)2↓
Mg2++2OH-═Mg(OH)2↓
.
(2)步骤②、③、④用到的试剂还可以有其他的添加顺序是
BaCl2、Na2CO3、NaOH或NaOH、BaCl2、Na2CO3
BaCl2、Na2CO3、NaOH或NaOH、BaCl2、Na2CO3
(填写化学式).
(3)步骤④中,相关的离子方程式
Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓
Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓
.
(4)若将步骤⑤与步骤⑥对调,先用盐酸调pH再过滤,将对实验结果产生的影响是
先加HCl会有少量CaCO3、BaCO3、Mg(OH)2沉淀溶解,使NaCl混有杂质,从而影响制得NaCl的纯度
先加HCl会有少量CaCO3、BaCO3、Mg(OH)2沉淀溶解,使NaCl混有杂质,从而影响制得NaCl的纯度
.
(5)实验室提纯NaCl的过程中,在溶解、过滤、蒸发三个步骤的操作中都要用玻璃棒,其中在蒸发时,使用的目的是
搅拌,防止局部过热液滴或晶体飞溅
搅拌,防止局部过热液滴或晶体飞溅
.


