
科目: 来源: 题型:







查看答案和解析>>
科目: 来源: 题型:阅读理解
| 4.8c(v2-v1) |
| m |
| 4.8c(v2-v1) |
| m |
查看答案和解析>>
科目: 来源: 题型:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 (×10-3 mol?L-1?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:阅读理解

| 序号 | 反应 | 平衡常数 |
| ① | Au+6HNO3(浓)?Au(NO3)3+3NO2+3H2O | <<1 |
| ② | Au3++4Cl-?AuCl4- | >>1 |

查看答案和解析>>
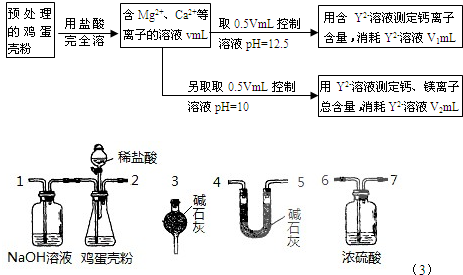
科目: 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
| 金属 | 电子流动方向 | 电压/V |
| Fe | Fe→Cu | +0.78 |
| Zn | Zn→Cu | +1.10 |
| A | Cu→A | -0.15 |
| B | B→Cu | +0.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com