
科目: 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)己达到平衡状态的是( )
C(g)+D(g)己达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值
⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1 : 1
A. ①③④⑤ B. ①③④⑤⑧⑨ C. ①②③④⑤⑦ D. ①②③④⑤⑥⑦⑧
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学设计如图装置,用过量浓硫酸与铜反应制取SO2,并探究SO2与Na2O2反应的产物。

完成下列填空:
(1)写出烧瓶中生成SO2的化学方程式__。
(2)细铜丝表面的实验现象是__,使用细铜丝的原因是__。
(3)欲使反应停止,应进行的操作是__,反应一段时间以后,将烧瓶中液体冷却后,可观察到白色固体,推断该白色固体是__,理由是__。
(4)将Na2O2粉末沾在玻璃棉上的目的是__,若Na2O2与SO2完全反应,生成Na2SO3、O2和Na2SO4。为检验混合物中有Na2SO4,实验方案是__。
(5)实验装置中广口瓶的作用是__。在含0.1molNaOH的溶液中不断地通入SO2,得到溶质的质量为8.35g,则烧杯中生产的溶质是__。两者的物质的量之比为__。
查看答案和解析>>
科目: 来源: 题型:
【题目】在恒容密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后改变某一条件,下列说法正确的是( )
2NH3(g)△H<0,达到平衡后改变某一条件,下列说法正确的是( )
A. 升高温度,正反应速率减小,逆反应速率增大,平衡逆向移动
B. 升高温度可提高N2转化率
C. 增加H2的浓度,可提高N2转化率
D. 改用高效催化剂,可增大反应的平衡常数
查看答案和解析>>
科目: 来源: 题型:
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示。
的合成路线(部分反应条件略去)如图所示。
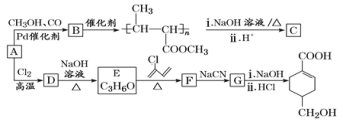
已知:![]() ;R—C
;R—C![]() N
N![]() R—COOH
R—COOH
完成下列填空:
(1)A的名称是__,A一定条件下与水加成,可以得到两种有机物,这两种有机物是__(填“同系物”或“同分异构体”或“同素异形体”)。
(2)C的结构简式为__,D→E的反应类型为__。
(3)E→F的化学方程式为__。
(4)B含有的官能团的名称是__(写名称)。B的同分异构很多,其中相同化学环境的氢原子有三种、比例为6:1:1且能发生银镜反应的是__(写结构简式,任写一种)。
(5)结合题给信息,以乙烯、HBr为起始原料制备丙酸,设计合成路线(其他试剂任选)。__
合成路线流程图示例:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体并使其发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
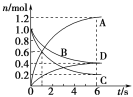
A. 该反应的化学方程式为3B+4D![]() 6A+2C
6A+2C
B. 0~1 s内,v(A)=v(C)
C. 0~6 s内,B的平均反应速率为0.05 mol·L-1·s-1
D. 0~6 s内,各物质的反应速率相等
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年IUPAC将合成化学元素第115号(Mc)提名为化学新元素,Mc的原子核最外层电子数是5,下列说法不正确的( )
A. Mc的原子核外有115个电子
B. Mc与N元素属于同一主族
C. Mc在同主族元素中金属性最强
D. 中子数为173的Mc核素符号是![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
完成下列填空:
(1)将二氧化氯通入品红试液中,看到的现象是__;理由是__。
(2)请配平下列反应的化学方程式(CH3OH中H为+1价,O为-2价):
___CH3OH+__NaClO3+__→__CO2↑+__C1O2↑+__Na2SO4+__□__
(3)该反应中,被氧化的元素是__。还原产物与氧化产物的物质的量之比是__。
(4)根据上述反应可推知__。
a.氧化性:C1O2>NaClO3 b.氧化性:NaClO3>CH3OH
c.还原性:CH3OH>ClO2 d.还原性:CH3OH>Na2SO4
(5)若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则反应产生气体(标准状况)为__升。
(6)消毒效率常以单位质量的消毒剂得到的电子数表示。ClO2的消毒效率是Cl2的__倍。
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室里,用足量的浓盐酸与一定量的MnO2反应,来制取氯气。
⑴用“双线桥法”标出电子转移情况
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
⑵若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
①理论上需要多少克MnO2参加反应?
②被氧化的HCl的物质的量为多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】磷酸氯喹(C18H32ClN3O8P2)是当前治疗冠状病毒的药物之一,而碳、氮、氯、磷等是其重要的组成元素。完成下列填空:
(1)碳原子核外有__个轨道;氯原子最外层电子的轨道表示式是__。
(2)属于同主族的两种元素,非金属性大小的关系是__(用元素符号表示)。
(3)已知磷酸是弱电解质,它的分子式为H3PO4。其酸式盐Na2HPO4的电离方程式是__。经测定Na2HPO4的水溶液呈弱碱性,请用学过的化学知识进行解释:__。
(4)常温下,在CH3COONa溶液中加入一定量的HCl,使其pH=7,则c(Cl-)_c(CH3COOH)(填“<”、“>”、“=”)。
(5)向2.0L恒容的密闭容器中充入1.0molPCl5,发生如下反应:PCl5(s)PCl3(g)+C12(g)-124kJ。控制体系温度不变,反应过程中测定的部分数据见下表:
时间/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
①该条件下平衡常数的表达式为__;前50s内Cl2的反应速率为__。
②要提高上述反应中反应物的转化率,可采取的措施有__、__(任写两点)。
向上述达到平衡③的反应体系中,再加入0.02molPCl3、0.02molC12,则平衡__。移动(选填“正向”、“逆向”、“不”),平衡常数__(选填“增大”、“减小”、“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液480 mL,根据这种溶液的配制情况回答下列问题:
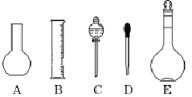
(1)如图所示的仪器中配制溶液肯定不需要的是__________ (填序号),仪器C的名称是__________,本实验所需玻璃仪器E规格为_____ mL。
(2)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)__________。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2 cm处
(3)在配制NaOH溶液实验中,若出现如下情况,其中将引起所配溶液浓度大于0.1mol/L的是_________;(填下列编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干
②定容观察液面时俯视
③配制过程中遗漏了(2)中步骤A
④加蒸馏水时不慎超过了刻度,立即用胶头滴管将多余的水吸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com