
【题目】二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
完成下列填空:
(1)将二氧化氯通入品红试液中,看到的现象是__;理由是__。
(2)请配平下列反应的化学方程式(CH3OH中H为+1价,O为-2价):
___CH3OH+__NaClO3+__→__CO2↑+__C1O2↑+__Na2SO4+__□__
(3)该反应中,被氧化的元素是__。还原产物与氧化产物的物质的量之比是__。
(4)根据上述反应可推知__。
a.氧化性:C1O2>NaClO3 b.氧化性:NaClO3>CH3OH
c.还原性:CH3OH>ClO2 d.还原性:CH3OH>Na2SO4
(5)若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则反应产生气体(标准状况)为__升。
(6)消毒效率常以单位质量的消毒剂得到的电子数表示。ClO2的消毒效率是Cl2的__倍。
【答案】试液变成无色 二氧化氯与水反应生成的次氯酸具有漂白性 CH3OH+6NaClO3+3H2SO4=CO2↑+6C1O2↑+3Na2SO4+5H2O CH3OH中-2价的碳 6:1 bc 7.84 2.63
【解析】
(1)利用二氧化氯遇水则生成次氯酸、氯气和氧气,分析品红试液褪色的原因;
(2)根据化合价升降法,确定氧化剂,还原剂的系数,根据原子守恒配平各原子的系数;
(3)被氧化的元素是化合价升高的元素,找到氧化产物和还原产物,找到他们之间的关系;
(4)根据氧化剂的氧化性大于氧化产物,还原剂的还原产物进行判断;
(5)找到转移的电子的物质的量和气体的物质的量关系;
(6)二氧化氯和氯气作为氧化剂,生成的产物是氯离子,根据单位质量的二氧化氯得到的电子数与单位质量的氯气得到的电子数的比值进行计算。
(1)二氧化氯与水反应生成的次氯酸具有漂白性,可以使品红褪色;
(2)根据元素守恒左边加入硫酸,右边加水,氧化剂是NaClO3,化合价从+5降低到+4价,化合价降低了1,CH3OH中碳元素的化合价从-2升高到+4价,化合价升高了6,根据氧化剂得电子的物质的量等于还原剂失电子的物质的量相等,配平氧化剂和还原剂的系数,根据元素守恒,配平其余物质,得到化学反应为: CH3OH+6NaClO3+3H2SO4=CO2↑+6C1O2↑+3Na2SO4+5H2O;
(3)该反应中,化合价升高的元素是CH3OH中-2价的碳,被氧化的元素是CH3OH中-2价的碳,还原产物是二氧化氯,氧化产物是二氧化碳,还原产物和氧化产物的物质的量之比是6:1;
(4)该反应中,氧化剂是NaClO3,还原剂是CH3OH,氧化产物是CO2,还原产物是C1O2,氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物,故氧化性:NaClO3>C1O2,NaClO3和CH3OH反应时,氧化剂是NaClO3,还原剂是CH3OH,说明氧化性:NaClO3>CH3OH,还原性:CH3OH>ClO2,答案选bc;
(5)根据甲醇和氯酸钠的化学反应可知,生成7mol气体,转移6mol电子,若转移的电子数目为0.3NA即0.3mol,则生成0.35mol气体,气体在标况下的体积为V=nVm=0.35×22.4L=7.84L;
(6) ,ClO2的消毒效率是Cl2的2.63倍。
,ClO2的消毒效率是Cl2的2.63倍。


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】下列对实验事实的解释错误的是( )
选项 | 实验事实 | 解释 |
A | 实验室用粗锌与稀盐酸反应制H2比纯锌快 | 粗锌与稀盐酸构成原电池 |
B | 浓硝酸保存在棕色试剂瓶中 | 4HNO3 |
C | 向10mL0.2mol·L-1ZnSO4,溶液中加入10mL0.4mol·L-1Na2S溶液,产生白色沉淀,再滴加CuSO4溶液,沉淀变黑 | Ksp(CuS)<Ksp(ZnS) |
D | 做过银镜反应的试管可用铁盐溶液洗涤,加入稀盐酸,清洗效果更好 | Fe3++Ag |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A. 提高反应体系的温度,能降低该反应体系中SO2生成量
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g) ![]() 3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s)![]() CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中发生如下可逆反应:2X(g)+Y(s)![]() 3Z(g) ΔH= QkJ/mol,下列说法正确的是
3Z(g) ΔH= QkJ/mol,下列说法正确的是
A. 消耗2 mol X同时生成3 mol Z,说明达到了平衡状态
B. 加入少量的Y正反应速率加快
C. 气体的密度不变时,说明达到了平衡状态
D. 加入少量的X,Q变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,用过量浓硫酸与铜反应制取SO2,并探究SO2与Na2O2反应的产物。

完成下列填空:
(1)写出烧瓶中生成SO2的化学方程式__。
(2)细铜丝表面的实验现象是__,使用细铜丝的原因是__。
(3)欲使反应停止,应进行的操作是__,反应一段时间以后,将烧瓶中液体冷却后,可观察到白色固体,推断该白色固体是__,理由是__。
(4)将Na2O2粉末沾在玻璃棉上的目的是__,若Na2O2与SO2完全反应,生成Na2SO3、O2和Na2SO4。为检验混合物中有Na2SO4,实验方案是__。
(5)实验装置中广口瓶的作用是__。在含0.1molNaOH的溶液中不断地通入SO2,得到溶质的质量为8.35g,则烧杯中生产的溶质是__。两者的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 NaHCO3溶液中:NH![]() 、H+、NO
、H+、NO![]() 、SO
、SO![]()
B.使酚酞变红色的溶液中:Mg2+、Fe2+、NO![]() 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液中:K+、Na+、Br-、SCN-
D.c(H+)=1×10-4 mol·L-1的溶液中:K+、Cu2+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】勒夏特列原理是自然界一条重要的基本原理,下列事实能用勒夏特列原理解释的是
A. NO2气体受压缩后,颜色先变深后变浅
B. 对2HI(g) ![]() H2(g)+I2(g)平衡体系加压,颜色迅速变深
H2(g)+I2(g)平衡体系加压,颜色迅速变深
C. 合成氨工业采用高温、高压工艺提高氨的产率
D. 配制硫酸亚铁溶液时,常加入少量铁屑以防止氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】传感器可以检测空气中SO2的含量,传感器的工作原理如图所示。下列叙述中正确的是( )
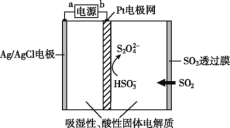
A.b为电源的正极
B.阳极的电极反应式为Ag++Cl-=AgCl
C.当电路中电子转移5×10-5 mol时,进入传感器的SO2为1.12 mL
D.阴极的电极反应式为2HSO3-+2H++2e-=S2O42-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com