
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 NaHCO3溶液中:NH![]() 、H+、NO
、H+、NO![]() 、SO
、SO![]()
B.使酚酞变红色的溶液中:Mg2+、Fe2+、NO![]() 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液中:K+、Na+、Br-、SCN-
D.c(H+)=1×10-4 mol·L-1的溶液中:K+、Cu2+、Cl-、SO![]()
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】我国许多城市为了减少燃煤造成的大气污染,对煤做了多方面的改进:
(1)为了除去煤中的含硫化合物,采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生反应如下:FeS2+14FeCl3+8H2O====2FeSO4+13FeCl2+16HCl(已知FeS2中硫元素的化合价为-1价)。
①该反应的氧化剂是____,若有1 mol FeS2被除去,则发生转移的电子的物质的量是___________。
②为了充分利用Fe2+并减少酸(HCl)污染,本方法中可利用工业废铁屑和Cl2让废液重新生成FeCl3。请写出这一过程中有关的离子方程式:______________;_____________________。
(2)“保护环境,就是保护人类自己”。飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气的污染物二氧化硫(SO2)接触时,二氧化硫(SO2)会部分转化为三氧化硫(SO3),其污染更加严重。
①飘尘所起的作用可能是______________.
A. 氧化剂B.还原剂C.催化剂D.载体
发生反应的化学方程式为________________________________________________.(如果是氧化还原反应,请用双线桥标出电子转移的方向和数目)
②冶金工业中常用高压电对气溶胶作用,以除去飘尘,减少对空气的污染,这种做法的依据是___.
A. 布朗运动 B.丁达尔现象 C. 渗析 D. 电泳。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a___1×10-14 (填“>”、“<”或“=”![]() ,作此判断的理由是___。
,作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___,此溶液中各种离子的浓度由大到小的排列顺序:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
完成下列填空:
(1)将二氧化氯通入品红试液中,看到的现象是__;理由是__。
(2)请配平下列反应的化学方程式(CH3OH中H为+1价,O为-2价):
___CH3OH+__NaClO3+__→__CO2↑+__C1O2↑+__Na2SO4+__□__
(3)该反应中,被氧化的元素是__。还原产物与氧化产物的物质的量之比是__。
(4)根据上述反应可推知__。
a.氧化性:C1O2>NaClO3 b.氧化性:NaClO3>CH3OH
c.还原性:CH3OH>ClO2 d.还原性:CH3OH>Na2SO4
(5)若转移的电子数目为0.3NA(NA为阿伏加德罗常数),则反应产生气体(标准状况)为__升。
(6)消毒效率常以单位质量的消毒剂得到的电子数表示。ClO2的消毒效率是Cl2的__倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和M在周期表中的位置如图所示,Y原子序数是X的2倍。下列说法不正确的是
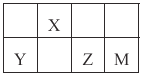
A. Z、M、X的简单离子半径依次减小
B. Y和M可形成离子化合物YM4
C. X的简单气态氢化物的稳定性强于Y的
D. M的最高价氧化物对应水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCN(aq)+NaOH(aq)=NaCN(aq)+H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;
则HCN在水溶液中电离的ΔH等于( )
A.-69.4 kJ·mol-1B.-45.2 kJ·mol-1C.+45.2 kJ·mol-1D.+69.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应X2+3Y2=2XY3的能量变化如图所示,该反应的热化学方程式是( )
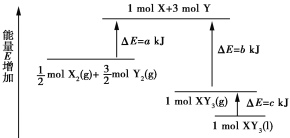
A.X2(g)+3Y2(g)=2XY3(l) ΔH =2(abc) kJ/mol
B.X2(g)+3Y2(g)=2XY3(g) ΔH =2(ba) kJ/mol
C.X2(g)+3Y2(g)=2XY3(l) ΔH =(b+ca) kJ/mol
D.X2(g)+3Y2(g)=2XY3(g) ΔH =(a+b) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH=-116 kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g);ΔH=-116 kJ·mol-1,测得反应的相关数据如下:
容 器 | 容器类型 | 初始 体积 | 初始压 强/Pa | 反应物投入量/mol | 平衡时Cl2的 物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
Ⅰ | 恒温恒容 | 1 L | 2×105 | 4 | 1 | 0 | 0 | 1 |
Ⅱ | 绝热恒容 | 1 L | p2 | 0 | 0 | 2 | 2 | a |
Ⅲ | 恒温恒压 | 2 L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105 Pa, p3=4×105 Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA 表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,4gH2含有的分子数为2NA
B.17g氨气所含电子数目为8NA
C.将1体积c1mol/L的硫酸溶于4体积水中 ,稀溶液的浓度为0.2c1mol/L
D.将5.85gNaCl 晶体溶入100mL水中,制得0.1mol/L的NaCl溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com