
【题目】如表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a___1×10-14 (填“>”、“<”或“=”![]() ,作此判断的理由是___。
,作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___,此溶液中各种离子的浓度由大到小的排列顺序:____。
【答案】> 温度升高,水的电离程度增大,离子积增加 c(Na+):c(OH-)=1000︰1 1×10-10mol/L 9︰11 c(Na+)>c(SO42-)>c(H+)>c(OH-)
【解析】
(1)水是弱电解质,存在电离平衡,电离过程为吸热反应,温度升高,水的电离程度增大,导致水的离子积增大,所以a>1×1014,
故答案为:>;升高温度,水的电离程度增大,离子积增大;
(2)硫酸钠溶液中一定满足c(Na+):c(SO42)=2:1;硫酸钠溶液中c(Na+)![]() ,稀释后c(Na+)
,稀释后c(Na+)![]() ,溶液呈中性, c(OH)=1×107mol·L1,c(Na+):c(OH)=1×104mol·L1:1×107mol·L1=1000:1,
,溶液呈中性, c(OH)=1×107mol·L1,c(Na+):c(OH)=1×104mol·L1:1×107mol·L1=1000:1,
故答案为:1000:1;
(3)pH=2的硫酸中c(H+)=102mol/L,根据图表可知t2℃下,Kw=1×1012,c(OH)=![]() mol/L=1×1010mol/L,
mol/L=1×1010mol/L,
故答案为:1×1010mol/L;
(4)混合液的pH=2,酸过量,则c(H+)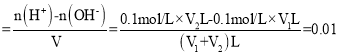 mol·L1,整理可得V1:V2=9:11,
mol·L1,整理可得V1:V2=9:11,
c(Na+)=![]() =0.045mol/L,c(SO42)=
=0.045mol/L,c(SO42)=![]() =0.0275mol/L,c(H+)=0.01mol/L,
=0.0275mol/L,c(H+)=0.01mol/L,
硫酸过量溶液显酸性,则(H+)>c(OH),则溶液中各种离子的浓度由大到小的排列顺序是:c(Na+)>c(SO42-)>c(H+)>c(OH-),
故答案为:9︰11; c(Na+)>c(SO42-)>c(H+)>c(OH-)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
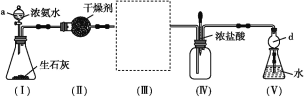
【题目】某校化学探究小组利用以下装置制取并探究氨气的性质。[已知生石灰与水反应生成Ca(OH)2并放出热量,实验室利用此原理往生石灰中滴加浓氨水,可以快速制取氨气。部分夹持仪器已略去]
(实验探究)
(1)装置(Ⅰ)中生石灰的化学式为________,仪器a的名称是_____。
(2)装置(Ⅱ)中的干燥剂可选用____(填“碱石灰”或“浓硫酸”)。
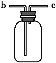
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气应从导管口_____(填“b”或“c”)通入集气瓶中。
(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,可观察到瓶内产生大量的______(填“白烟”或“白雾”),写出NH3与HCl反应的化学方程式:___________。
(5)装置(Ⅴ)中仪器d的作用是_______。取装置(Ⅴ)中的少量氨水于试管中,滴入1~2滴酚酞试液,溶液显____(填“无色”或“红色”),其原因是_______。
(知识应用)
(6)液氨可作制冷剂是由于液氨汽化时_____(填“吸收”或“放出”)大量的热,使周围环境的温度降低。
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+5O2![]() 4NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
4NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼烯具有优异的电学、力学、热学等属性,将成为继石墨烯之后又一种“神奇纳米材料”。科学家已成功合成多种结构的硼烯,如图为“皱褶”式硼烯的结构。下列说法错误的是( )

A.“皱褶”式硼烯中每个硼原子共用3对电子
B.“皱褶”式硼烯中硼原子达到8电子稳定结构
C.硼烯有望代替石墨烯作电极材料
D.氧化硼的水化物是一种弱酸,与过量OH-反应可生成B(OH)4-或BO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一包白色粉末,由BaCl2、K2SO4、CaCO3、NaOH、CuSO4中的一种或几种组成,为了探究它的成份,进行了如下实验:下列判断正确的是( )

A. BaCl2,CaCO3一定存在,NaOH可能存在
B. K2SO4、CuSO4一定不存在
C. K2SO4、NaOH、CaCO3、BaCl2一定存在,CuSO4可能存在
D. C为单一溶质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4 kJ/mol(反应I)
CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
CaS(s)+4CO2(g) △H2=-175.6 kJ/mol (反应II)
下列有关说法正确的是( )
A. 提高反应体系的温度,能降低该反应体系中SO2生成量
B. 反应II在较低的温度下可自发进行
C. 用生石灰固硫的反应为:4CaO(s)+4SO2(g) ![]() 3CaSO4(s)+CaS(s) △H3,则△H3>△H2
3CaSO4(s)+CaS(s) △H3,则△H3>△H2
D. 由反应I和反应II可计算出反应CaSO4(s)![]() CaO(s)+SO3(g)的焓变
CaO(s)+SO3(g)的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中发生如下可逆反应:2X(g)+Y(s)![]() 3Z(g) ΔH= QkJ/mol,下列说法正确的是
3Z(g) ΔH= QkJ/mol,下列说法正确的是
A. 消耗2 mol X同时生成3 mol Z,说明达到了平衡状态
B. 加入少量的Y正反应速率加快
C. 气体的密度不变时,说明达到了平衡状态
D. 加入少量的X,Q变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 NaHCO3溶液中:NH![]() 、H+、NO
、H+、NO![]() 、SO
、SO![]()
B.使酚酞变红色的溶液中:Mg2+、Fe2+、NO![]() 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液中:K+、Na+、Br-、SCN-
D.c(H+)=1×10-4 mol·L-1的溶液中:K+、Cu2+、Cl-、SO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
②5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
③2L0.5mol/L亚硫酸溶液中含有的H+为2NA
④3mol单质铁完全转化为Fe3O4,失去8NA个电子
⑤密闭容器中2molNO与1molO2充分反应后,产物的分子数为2NA
⑥将100mL0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
A. ①③⑤B. ④⑤⑥C. ①②④D. ①⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com