
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
②5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28gN2时,转移的电子数目为3.75NA
③2L0.5mol/L亚硫酸溶液中含有的H+为2NA
④3mol单质铁完全转化为Fe3O4,失去8NA个电子
⑤密闭容器中2molNO与1molO2充分反应后,产物的分子数为2NA
⑥将100mL0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
A. ①③⑤B. ④⑤⑥C. ①②④D. ①⑥
【答案】C
【解析】
①过氧化钠与水反应为歧化反应,生成1mol氧气转移2mol电子,所以生成0.1mol氧气转移的电子数为0.2NA,①项正确;
②5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,-3价的氮元素升高到0价,失去3个电子。+5价的氮元素降低到0价,得到5个电子,即每生成4mol氮气反应中转移电子的物质的量是15mol。因此生成28g N2即1mol氮气时,转移电子的物质的量是
2HNO3+4N2↑+9H2O反应中,-3价的氮元素升高到0价,失去3个电子。+5价的氮元素降低到0价,得到5个电子,即每生成4mol氮气反应中转移电子的物质的量是15mol。因此生成28g N2即1mol氮气时,转移电子的物质的量是![]() mol=3.75mol,其的电子数目为3.75NA,②项正确;
mol=3.75mol,其的电子数目为3.75NA,②项正确;
③亚硫酸是弱酸,在溶液中不能完全电离,故溶液中的氢离子的个数小于2NA个,③项错误;
④Fe3O4中铁为+![]() 价,故1mol铁反应失去
价,故1mol铁反应失去![]() mol电子,3mol单质Fe完全转化为Fe3O4失去8mol电子,即8NA个,④项正确;
mol电子,3mol单质Fe完全转化为Fe3O4失去8mol电子,即8NA个,④项正确;
⑤NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2N2O4,所以产物分子数小于2NA,⑤项错误;
⑥胶体微粒是氢氧化铁的聚集体,将100 mL 0.1molL1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒小于0.01NA,⑥项错误;
综上所述,①②④符合题意,C项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】如表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a___1×10-14 (填“>”、“<”或“=”![]() ,作此判断的理由是___。
,作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___,此溶液中各种离子的浓度由大到小的排列顺序:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应X2+3Y2=2XY3的能量变化如图所示,该反应的热化学方程式是( )
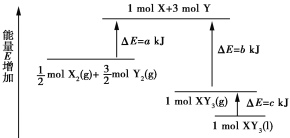
A.X2(g)+3Y2(g)=2XY3(l) ΔH =2(abc) kJ/mol
B.X2(g)+3Y2(g)=2XY3(g) ΔH =2(ba) kJ/mol
C.X2(g)+3Y2(g)=2XY3(l) ΔH =(b+ca) kJ/mol
D.X2(g)+3Y2(g)=2XY3(g) ΔH =(a+b) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH=-116 kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g);ΔH=-116 kJ·mol-1,测得反应的相关数据如下:
容 器 | 容器类型 | 初始 体积 | 初始压 强/Pa | 反应物投入量/mol | 平衡时Cl2的 物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
Ⅰ | 恒温恒容 | 1 L | 2×105 | 4 | 1 | 0 | 0 | 1 |
Ⅱ | 绝热恒容 | 1 L | p2 | 0 | 0 | 2 | 2 | a |
Ⅲ | 恒温恒压 | 2 L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105 Pa, p3=4×105 Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,3.36L氧气与3.2g硫反应,生成SO2分子数为0.1NA
B.1L0.1mol·L-1氨水中NH3·H2O分子数为0.1NA
C.标准状况下,1.12L氯气发生反应转移的电子数一定为0.1NA
D.46gNO2和N2O4混合气体中氧原子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水是重要的化学试剂。
(1)一定条件下,O2得电子转化为超氧自由基(·O![]() ),并实现如下图所示的转化:
),并实现如下图所示的转化:
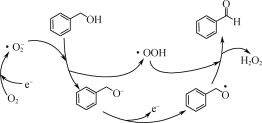
①![]() 是________(填“氧化”或“还原”)反应。
是________(填“氧化”或“还原”)反应。
②写出图示转化总反应的化学方程式:________。
(2) K2Cr2O7酸性条件下与H2O2反应生成CrO5,反应为非氧化还原反应。据此分析,CrO5中-2价O与-1价O的数目比为________。
(3) H2O2可用于测定酒精饮料中乙醇的含量。现有20.00 mL某鸡尾酒,将其中CH3CH2OH蒸出并通入17.0 mL 0.200 0 mol·L-1 K2Cr2O7溶液(H2SO4酸化)中,发生反应:K2Cr2O7+C2H5OH+H2SO4―→Cr2(SO4)3+CH3COOH+K2SO4+H2O(未配平)
再用0.400 0 mol·L-1的双氧水滴定反应后所得的混合液,用去19.00 mL双氧水,滴定过程中发生如下反应:
反应1:4H2O2+K2Cr2O7+H2SO4===K2SO4+2CrO5+5H2O
反应2:H2O2+CH3COOH===CH3COOOH+H2O
则该鸡尾酒中CH3CH2OH的物质的量浓度为________mol·L-1(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 1mol Na被完全氧化生成Na2O2,失去2NA个电子
B. 0.5mol锌粒与足量的盐酸反应产生H2为11.2L
C. 电解58.5g熔融的氯化钠,能产生23.0g金属钠、22.4L氯气(标准状况)
D. 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA 表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,4gH2含有的分子数为2NA
B.17g氨气所含电子数目为8NA
C.将1体积c1mol/L的硫酸溶于4体积水中 ,稀溶液的浓度为0.2c1mol/L
D.将5.85gNaCl 晶体溶入100mL水中,制得0.1mol/L的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学源于生活,在生产生活中,我们会遇到各种各样的化学反应。
(1)过氧化钠用于潜水艇或呼吸面具做供氧剂,主要反应的化学方程式为:_____。
(2)工业上用电解饱和食盐水的方法生产氯气,即“氯碱工业”,写出反应的化学方程式:_____。
(3)野外作业中用于焊接铁轨,该反应的化学方程式为:_____。
(4)将一个铝制易拉罐充满CO2气体,然后往罐内注入足量的NaOH溶液,立即密封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后又重新鼓起。试用离子方程式解释易拉罐又重新鼓起的原因______。
(5)用小苏打治疗胃酸过多,反应的离子方程式为:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com