
°ĺŐ‚ńŅ°Ņ≥ű ľő¬∂»ő™t °ś£¨ŌÚ»żłŲ√‹Ī’Ķń»›∆ų÷–įī≤ĽÕ¨∑Ĺ ĹÕ∂»Ž∑ī”¶őÔ£¨∑Ę…ķ∑ī”¶£ļ4HCl(g)£ęO2(g)![]() 2Cl2(g)£ę2H2O(g)£Ľ¶§H£Ĺ£≠116 kJ°§mol£≠1£¨≤‚Ķ√∑ī”¶ĶńŌŗĻō żĺ›»ÁŌ¬£ļ
2Cl2(g)£ę2H2O(g)£Ľ¶§H£Ĺ£≠116 kJ°§mol£≠1£¨≤‚Ķ√∑ī”¶ĶńŌŗĻō żĺ›»ÁŌ¬£ļ
»› ∆ų | »›∆ųņŗ–Õ | ≥ű ľ ŐŚĽż | ≥ű ľ—Ļ «Ņ/Pa | ∑ī”¶őÔÕ∂»ŽŃŅ/mol | ∆Ĺļ‚ ĪCl2Ķń őÔ÷ ĶńŃŅ/mol | |||
HCl | O2 | Cl2 | H2O | |||||
ĘŮ | ļ„ő¬ļ„»› | 1 L | 2°Ń105 | 4 | 1 | 0 | 0 | 1 |
ĘÚ | ĺÝ»»ļ„»› | 1 L | p2 | 0 | 0 | 2 | 2 | a |
Ęů | ļ„ő¬ļ„—Ļ | 2 L | p3 | 8 | 2 | 0 | 0 | b |
Ō¬Ń–ňĶ∑®’ż»∑Ķń «(°°)
A.∑ī”¶4HCl(g)£ęO2(g)2Cl2(g)£ę2H2O(l)Ķń¶§H>£≠116 kJ°§mol£≠1
B.a>1, b>2
C.p2£Ĺ1.6°Ń105 Pa, p3£Ĺ4°Ń105 Pa
D.»Ű∆ū ľŌÚ»›∆ųĘŮ÷–≥š»Ž0.5 mol HCl°Ę0.5 mol O2°Ę0.5 mol Cl2ļÕ0.5 mol H2O£¨‘Ú∑ī”¶ŌÚńś∑ī”¶∑ĹŌÚĹÝ––
°ĺīūįł°ŅBD
°ĺĹ‚őŲ°Ņ
»żłŲ»›∆ų÷–£¨ĘŮ”ŽĘÚĺýő™ļ„»›»›∆ų£¨≤ÓĪū‘ŕ”ŕ«į’Ŗļ„ő¬£¨ļů’ŖĺÝ»»£Ľ≤Ľ∑Ń…ŤŌŽ»›∆ųĘŰ£¨∆š”Ž»›∆ųĘŮ∆š”ŗĶńŐűľĢŌŗÕ¨£¨ĹŲÕ∂ŃŌ∑Ĺ Ĺįī’’»›∆ųĘÚ÷–ĶńÕ∂ŃŌ∑Ĺ ĹĹÝ––£¨ń«√ī»›∆ųĘŰ÷–Ķń∆Ĺļ‚”ŽĘŮ÷–ĶńĶ»–ߣ¨»›∆ųĘŰ÷–Ķń∑ī”¶īÔĶĹ∆Ĺļ‚ Ī£¨Cl2ĶńőÔ÷ ĶńŃŅő™1mol°£»›∆ųĘůŌŗĪ»”ŕ»›∆ųĘŮ£¨ŐŚĽżņ©īůŃň“ĽĪ∂£¨≥ű ľÕ∂ŃŌ“≤‘Ųľ”Ńň“ĽĪ∂£¨Ķę»›∆ųĘů «‘ŕļ„ő¬ļ„—ĻĶńŐűľĢŌ¬∑ī”¶Ķń£Ľ≤Ľ∑Ń…ŤŌŽ»›∆ųĘű£¨∆š”Ž»›∆ųĘůĶń∆šňŻĶńŐűľĢŌŗÕ¨£¨ĹŲ»›∆ųņŗ–ÕłŁłńő™ļ„ő¬ļ„»›Ķń»›∆ų£¨ń«√ī»›∆ųĘű÷–Ķń∆Ĺļ‚◊īŐ¨”ŽĘŮ÷–ĶńĶ»–ߣ¨»›∆ųĘű÷–Ķń∑ī”¶īÔĶĹ∆Ĺļ‚ Ī£¨Cl2ĶńőÔ÷ ĶńŃŅő™2mol°£
A£ģ…ķ≥…“ļŐ¨ňģŌŗĪ»”ŕ…ķ≥…∆ÝŐ¨ňģ£¨Õ¨Ķ»ŐűľĢŌ¬∑Ň≥ŲĶń»»ŃŅłŁ∂ŗ£¨∑Ň»»‘Ĺ∂ŗ∑ī”¶Ķń![]() ‘Ĺ–°£¨“Úīň∑ī”¶4HCl(g)£ęO2(g)2Cl2(g)£ę2H2O(l)Ķń
‘Ĺ–°£¨“Úīň∑ī”¶4HCl(g)£ęO2(g)2Cl2(g)£ę2H2O(l)Ķń![]() £ľ-116kJ/mol£¨AŌÓīŪőů£Ľ
£ľ-116kJ/mol£¨AŌÓīŪőů£Ľ
B£ģĻĻ‘žĶń»›∆ųĘŰĶńņŗ–Õ «ļ„ő¬ļ„»›£¨»›∆ųĘÚĶńņŗ–Õ «ĺÝ»»ļ„»›£¨∂Ģ’Ŗ∂ľ «ńśŌÚ∑ī”¶Ĺ®ŃĘĶń∆Ĺļ‚◊īŐ¨£¨»›∆ųĘÚ”…”ŕ «ĺÝ»»Ķń£¨ňý“‘»›∆ųĘÚ÷–Ķńő¬∂»ĽŠ‘Ĺņī‘ĹĶÕ£¨≤ĽņŻ”ŕ∑ī”¶ńśŌÚĹÝ––£¨ŌŗĪ»”ŕ»›∆ųĘŰīÔĶĹ∆Ĺļ‚ ĪŌŻļńĶńCl2łŁ…Ŕ£¨ňý“‘a£ĺ1£ĽĻĻ‘žĶń»›∆ųĘűĶńņŗ–Õő™ļ„ő¬ļ„»›£¨»›∆ųĘůĶńņŗ–Õő™ļ„ő¬ļ„—Ļ£¨∂Ģ’Ŗ∂ľ «’żŌÚ∑ī”¶Ĺ®ŃĘĶń∆Ĺļ‚£¨”…”ŕ»›∆ųĘűő™ļ„»›»›∆ų£¨ňý“‘∑ī”¶Ņ™ ľļů»›∆ųĘű÷–Ķń—Ļ«Ņ÷ūĹ•–°”ŕ»›∆ųĘů÷–Ķń—Ļ«Ņ£¨—Ļ«Ņ‘Ĺ–°‘Ĺ≤ĽņŻ”ŕ∑ī”¶’żŌÚĹÝ––£¨“Úīň∆Ĺļ‚ Ī£¨»›∆ųĘű÷–ĶńCl2ĶńŃŅ–°”ŕ»›∆ųĘů÷–Ķń£¨ňý“‘b£ĺ2£¨BŌÓ’ż»∑£Ľ
C£ģ»żłŲ»›∆ųĶń≥ű ľő¬∂»ŌŗÕ¨£¨łýĺ›Ļę Ĺ![]() £¨»›∆ųĘŮ”ŽĘÚ£¨ŐŚĽżŌŗÕ¨£¨ń«√ī
£¨»›∆ųĘŮ”ŽĘÚ£¨ŐŚĽżŌŗÕ¨£¨ń«√ī![]() £¨ňý“‘
£¨ňý“‘![]() £Ľ»›∆ųĘŮ”ŽĘů£¨ŐŚĽż÷ģĪ»ő™1:2£¨őÔ÷ ĶńŃŅ÷ģĪ»“≤ő™1:2£¨ňý“‘∂Ģ’Ŗ—Ļ«ŅŌŗĶ»£¨ňý“‘
£Ľ»›∆ųĘŮ”ŽĘů£¨ŐŚĽż÷ģĪ»ő™1:2£¨őÔ÷ ĶńŃŅ÷ģĪ»“≤ő™1:2£¨ňý“‘∂Ģ’Ŗ—Ļ«ŅŌŗĶ»£¨ňý“‘![]() £¨CŌÓīŪőů£Ľ
£¨CŌÓīŪőů£Ľ
D£ģ»›∆ųĘŮīÔĶĹ∆Ĺļ‚ Ī£¨¬»∆Ýő™1mol£¨”…∑ī”¶∑Ĺ≥Ő ĹŅ…÷™£¨HClĶńőÔ÷ ĶńŃŅő™2mol£¨O2ĶńőÔ÷ ĶńŃŅő™0.5mol£¨H2OĶńőÔ÷ ĶńŃŅő™1mol£Ľł√»›∆ųŐŚĽżő™1L£¨ňý“‘‘ŕīňő¬∂»Ō¬£¨ł√∑ī”¶Ķń∆Ĺļ‚≥£ żő™£ļ![]() £Ľ»Ű≥ű ľ Ī£¨ŌÚ»›∆ų÷–≥š»Žĺýő™0.5molĶńňń÷÷őÔ÷ £¨‘Ú
£Ľ»Ű≥ű ľ Ī£¨ŌÚ»›∆ų÷–≥š»Žĺýő™0.5molĶńňń÷÷őÔ÷ £¨‘Ú![]() £¨ňý“‘∑ī”¶ńśŌÚĹÝ––£¨DŌÓ’ż»∑£Ľ
£¨ňý“‘∑ī”¶ńśŌÚĹÝ––£¨DŌÓ’ż»∑£Ľ
īūįł—°BD°£


 ŐōłŖľ∂ĹŐ ¶Ķ„≤¶ŌĶŃ–īūįł
ŐōłŖľ∂ĹŐ ¶Ķ„≤¶ŌĶŃ–īūįł
| ńÍľ∂ | łŖ÷–Ņő≥Ő | ńÍľ∂ | ≥ű÷–Ņő≥Ő |
| łŖ“Ľ | łŖ“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű“Ľ | ≥ű“Ľ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ∂Ģ | łŖ∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű∂Ģ | ≥ű∂Ģ√‚∑—Ņő≥ŐÕ∆ľŲ£° |
| łŖ»ż | łŖ»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° | ≥ű»ż | ≥ű»ż√‚∑—Ņő≥ŐÕ∆ľŲ£° |
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņį≤»ę «ň≥ņŻĹÝ–– Ķ—ťľįĪ‹√‚…ňļ¶ĶńĪ£’Ō.Ō¬Ń– Ķ—ť≤Ŕ◊ų’ż»∑«“≤Ľ «ī” Ķ—ťį≤»ęĹ«∂»Ņľ¬«Ķń «£® £©

A. ≤Ŕ◊ųĘŔ£ļ Ļ”√…‘ĹĢ»Ž“ļ√śŌ¬ĶńĶĻŅج©∂∑ľž—ť«‚∆ÝĶńīŅ∂»
B. ≤Ŕ◊ųĘŕ£ļ Ļ”√CCl4›Õ»°šŚňģ÷–ĶńšŚ Ī£¨’ŮĶīļů–ŤīÚŅ™ĽÓ»Ż Ļ¬©∂∑ńŕ∆ÝŐŚ∑Ň≥Ų
C. ≤Ŕ◊ųĘŘ£ļőŁ ’įĪ∆ÝĽÚ¬»ĽĮ«‚∆ÝŐŚ≤Ę∑ņ÷ĻĶĻőŁ
D. ≤Ŕ◊ųĘ‹£ļ”√ ≥÷ł∂•◊°∆Ņ»Ż£¨ŃŪ“Ľ÷Ľ ÷Õ–◊°∆ŅĶ◊£¨į—∆ŅĶĻŃĘ£¨ľž≤ť»›ŃŅ∆Ņ «∑٬©ňģ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ≥£ő¬Ō¬£¨Ō¬Ń–łų◊ťņŽ◊”‘ŕ÷ł∂®»‹“ļ÷–ń‹īůŃŅĻ≤īśĶń «(°°°°)
A.0.1 mol°§L£≠1 NaHCO3»‹“ļ÷–£ļNH![]() °ĘH£ę°ĘNO
°ĘH£ę°ĘNO![]() °ĘSO
°ĘSO![]()
B. Ļ∑”Ő™Īšļž…ęĶń»‹“ļ÷–£ļMg2£ę°ĘFe2£ę°ĘNO![]() °ĘCl£≠
°ĘCl£≠
C.0.1 mol°§L£≠1 FeCl3»‹“ļ÷–£ļK£ę°ĘNa£ę°ĘBr£≠°ĘSCN£≠
D.c(H£ę)£Ĺ1°Ń10£≠4 mol°§L£≠1Ķń»‹“ļ÷–£ļK£ę°ĘCu2£ę°ĘCl£≠°ĘSO![]()
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņņ’ŌńŐōŃ–‘≠ņŪ «◊‘»ĽĹÁ“ĽŐű÷ō“™ĶńĽýĪĺ‘≠ņŪ,Ō¬Ń– ¬ Ķń‹”√ņ’ŌńŐōŃ–‘≠ņŪĹ‚ ÕĶń «
A. NO2∆ÝŐŚ ‹—Ļňűļů£¨—’…ęŌ»Īš…ÓļůĪš«≥
B. ∂‘2HI(g) ![]() H2(g)£ęI2(g)∆Ĺļ‚ŐŚŌĶľ”—Ļ£¨—’…ę—łňŔĪš…Ó
H2(g)£ęI2(g)∆Ĺļ‚ŐŚŌĶľ”—Ļ£¨—’…ę—łňŔĪš…Ó
C. ļŌ≥…įĪĻ§“Ķ≤…”√łŖő¬°ĘłŖ—ĻĻ§“’ŐŠłŖįĪĶń≤ķ¬
D. Ňš÷∆ŃÚňŠ—«Őķ»‹“ļ Ī£¨≥£ľ”»Ž…ŔŃŅŐķ–ľ“‘∑ņ÷Ļ—űĽĮ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ‘ŕ√‹Ī’»›∆ų÷–£¨“Ľ∂®ŐűľĢŌ¬£¨ĹÝ––»ÁŌ¬∑ī”¶£ļNO(g)£ęCO(g) ![]()
![]() N2(g)+CO2(g)£Ľ¶§H= -373.2kJ/mol£¨īÔĶĹ∆Ĺļ‚ļů£¨ő™ŐŠłŖł√∑ī”¶ĶńňŔ¬ ļÕNOĶń◊™ĽĮ¬ £¨≤…»°Ķń’ż»∑īŽ © «
N2(g)+CO2(g)£Ľ¶§H= -373.2kJ/mol£¨īÔĶĹ∆Ĺļ‚ļů£¨ő™ŐŠłŖł√∑ī”¶ĶńňŔ¬ ļÕNOĶń◊™ĽĮ¬ £¨≤…»°Ķń’ż»∑īŽ © «
A.ľ”īŖĽĮľŃÕ¨ Ī…żłŖő¬∂»B.ľ”īŖĽĮľŃÕ¨ Ī‘Ųīů—Ļ«Ņ
C.…żłŖő¬∂»Õ¨ Ī≥š»ŽN2D.ĹĶĶÕő¬∂»Õ¨ Ī‘Ųīů—Ļ«Ņ
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°ŅĽÓ–‘ŐŅŅ…”√”ŕī¶ņŪīů∆ÝőŘ»ĺőÔNO°£‘ŕ1 L√‹Ī’»›∆ų÷–ľ”»ŽNOļÕ
ĽÓ–‘ŐŅ(őř‘”÷ )£¨…ķ≥…∆ÝŐŚEļÕF°£ĶĪő¬∂»∑÷Īū‘ŕT1°śļÕT2°ś Ī£¨≤‚Ķ√∆Ĺļ‚ ĪłųőÔ÷ ĶńőÔ÷ ĶńŃŅ»ÁŌ¬ĪŪ£ļ
°°°°°°°°°°őÔ÷ n/mol | ĽÓ–‘ŐŅ | NO | E | F |
≥ű ľ | 2.030 | 0.100 | 0 | 0 |
T1 | 2.000 | 0.040 | 0.030 | 0.030 |
T2 | 2.005 | 0.050 | 0.025 | 0.025 |
(1)«ŽĹŠļŌ…ŌĪŪ żĺ›£¨–ī≥ŲNO”ŽĽÓ–‘ŐŅ∑ī”¶ĶńĽĮ—ß∑Ĺ≥Ő Ĺ£ļ___________°£
(2)…Ō Ų∑ī”¶‘ŕT1°ś ĪĶń∆Ĺļ‚≥£ żő™K1£¨‘ŕT2°ś ĪĶń∆Ĺļ‚≥£ żő™K2°£
ĘŔľ∆ň„K1£Ĺ_______________°£
Ęŕłýĺ›…Ō Ų–ŇŌĘŇ–∂Ō£¨T1ļÕT2ĶńĻōŌĶ «_______(ŐÓ–ÚļŇ)°£
a£ģT1£ĺT2b£ģT1£ľT2c£ģőř∑®Ī»ĹŌ
(3)‘ŕT1°śŌ¬∑ī”¶īÔĶĹ∆Ĺļ‚ļů£¨Ō¬Ń–īŽ ©≤Ľń‹łńĪšNOĶń◊™ĽĮ¬ Ķń «_______(ŐÓ–ÚļŇ)°£
a£ģ‘Ųīůc(NO) b£ģ‘Ųīů—Ļ«Ņ
c£ģ…żłŖő¬∂» d£ģ“∆»•≤Ņ∑÷F
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņ…ŤNAĪŪ ĺįĘ∑Łľ”Ķ¬¬ř≥£ żĶń÷Ķ£¨Ō¬Ń–ňĶ∑®÷–’ż»∑Ķń «£® £©
ĘŔĻż—űĽĮń∆”Žňģ∑ī”¶ Ī£¨…ķ≥…0.1mol—ű∆Ý◊™“∆ĶńĶÁ◊” żő™0.2NA
Ęŕ5NH4NO3![]() 2HNO3£ę4N2°Ł£ę9H2O∑ī”¶÷–£¨…ķ≥…28gN2 Ī£¨◊™“∆ĶńĶÁ◊” żńŅő™3.75NA
2HNO3£ę4N2°Ł£ę9H2O∑ī”¶÷–£¨…ķ≥…28gN2 Ī£¨◊™“∆ĶńĶÁ◊” żńŅő™3.75NA
ĘŘ2L0.5mol/L—«ŃÚňŠ»‹“ļ÷–ļ¨”–ĶńH+ő™2NA
Ę‹3molĶ•÷ ŐķÕÍ»ę◊™ĽĮő™Fe3O4£¨ ß»•8NAłŲĶÁ◊”
Ę›√‹Ī’»›∆ų÷–2molNO”Ž1molO2≥š∑÷∑ī”¶ļů£¨≤ķőÔĶń∑÷◊” żő™2NA
ĘřĹę100mL0.1mol/LĶńFeCl3»‹“ļĶő»Ž∑–ňģ÷–Ņ…÷∆Ķ√Fe(OH)3ĹļŃ£0.01NA
A. ĘŔĘŘĘ›B. Ę‹Ę›ĘřC. ĘŔĘŕĘ‹D. ĘŔĘř
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņīęł–∆ųŅ…“‘ľž≤‚Ņ’∆Ý÷–SO2Ķńļ¨ŃŅ£¨īęł–∆ųĶńĻ§◊ų‘≠ņŪ»ÁÕľňý ĺ°£Ō¬Ń––ū Ų÷–’ż»∑Ķń «(°°°°)
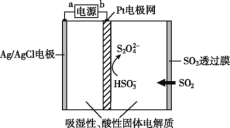
A.bő™ĶÁ‘īĶń’żľę
B.—ŰľęĶńĶÁľę∑ī”¶ Ĺő™Ag++Cl-=AgCl
C.ĶĪĶÁ¬∑÷–ĶÁ◊”◊™“∆5°Ń10-5 mol Ī£¨ĹÝ»Žīęł–∆ųĶńSO2ő™1.12 mL
D.“űľęĶńĶÁľę∑ī”¶ Ĺő™2HSO3-+2H++2e-=S2O42-+2H2O
≤ťŅīīūįłļÕĹ‚őŲ>>
Ņ∆ńŅ£ļłŖ÷–ĽĮ—ß ņī‘ī£ļ Ő‚–Õ£ļ
°ĺŐ‚ńŅ°Ņłýĺ›Ķ‚”Ž«‚∆Ý∑ī”¶Ķń»»ĽĮ—ß∑Ĺ≥Ő Ĺ£¨Ō¬Ń–Ň–∂Ō’ż»∑Ķń «
ĘŔI2(g)£ęH2(g) ![]() 2HI(g)°°¶§H£Ĺ£≠9.48 kJ/mol
2HI(g)°°¶§H£Ĺ£≠9.48 kJ/mol
ĘŕI2(s)£ęH2(g) ![]() 2HI(g)°°¶§H£Ĺ£ę26.48 kJ/mol
2HI(g)°°¶§H£Ĺ£ę26.48 kJ/mol
A. 254 g I2(g)÷–Õ®»Ž2 g H2(g)£¨∑ī”¶∑Ň»»9.48 kJ
B. 1 molĻŐŐ¨Ķ‚”Ž1 mol∆ÝŐ¨Ķ‚ňýļ¨ń‹ŃŅŌŗ≤Ó17.00 kJ
C. ∑ī”¶ĘŕĶń∑ī”¶őÔ◊‹ń‹ŃŅĪ»∑ī”¶ĘŔĶń∑ī”¶őÔ◊‹ń‹ŃŅĶÕ
D. ĶĪ∑ī”¶ĘŕőŁ ’52.96 kJ»»ŃŅ Ī◊™“∆2 molĶÁ◊”
≤ťŅīīūįłļÕĹ‚őŲ>>
Ļķľ —ß–£”Ň—° - Ń∑Ōį≤ŠŃ–ĪŪ - ‘Ő‚Ń–ĪŪ
ļĢĪĪ °Ľ•Ń™ÕÝő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®∆ĹŐ® | ÕÝ…Ō”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | ĶÁ–Ň’©∆≠ĺŔĪ®◊®«Ý | …śņķ ∑–ťőř÷ų“Ś”–ļ¶–ŇŌĘĺŔĪ®◊®«Ý | …ś∆ů«÷»®ĺŔĪ®◊®«Ý
ő•∑®ļÕ≤ĽŃľ–ŇŌĘĺŔĪ®ĶÁĽį£ļ027-86699610 ĺŔĪ®” Ōš£ļ58377363@163.com