
【题目】根据碘与氢气反应的热化学方程式,下列判断正确的是
①I2(g)+H2(g) ![]() 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
②I2(s)+H2(g) ![]() 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
A. 254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B. 1 mol固态碘与1 mol气态碘所含能量相差17.00 kJ
C. 反应②的反应物总能量比反应①的反应物总能量低
D. 当反应②吸收52.96 kJ热量时转移2 mol电子
【答案】C
【解析】
I2(g)+H2(g)2HI(g)△H=-9.48kJmol-1;
②I2(s)+H2(g)2HI(g)△H=+26.48kJmol-1,
利用盖斯定律将①-②可得I2(g)=I2(s)△H=-9.48kJmol-1-26.48kJmol-1=-35.96kJmol-1,根据二者转化的热化学方程式判断。
A. 254gI2(g)的物质的量为1moL,n(H2)=1mol,由于该反应为可逆反应,则放出的热量小于9.48kJ,故A错误;
B. 由I2(g)=I2(s)△H=35.96kJmol1,可知1mol固态碘与1mol气态碘所含的能量相差35.96kJ,故B错误。
C. 由I2(g)=I2(s)△H=35.96kJmol1,可知I2(g)能量大于I2(s),则反应②的反应物总能量比反应①的反应物总能量低,故C正确;
D. 当反应②吸收52.96kJ热量时,反应了2mol氢气电子转移4mole,故D错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】初始温度为t ℃,向三个密闭的容器中按不同方式投入反应物,发生反应:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g);ΔH=-116 kJ·mol-1,测得反应的相关数据如下:
2Cl2(g)+2H2O(g);ΔH=-116 kJ·mol-1,测得反应的相关数据如下:
容 器 | 容器类型 | 初始 体积 | 初始压 强/Pa | 反应物投入量/mol | 平衡时Cl2的 物质的量/mol | |||
HCl | O2 | Cl2 | H2O | |||||
Ⅰ | 恒温恒容 | 1 L | 2×105 | 4 | 1 | 0 | 0 | 1 |
Ⅱ | 绝热恒容 | 1 L | p2 | 0 | 0 | 2 | 2 | a |
Ⅲ | 恒温恒压 | 2 L | p3 | 8 | 2 | 0 | 0 | b |
下列说法正确的是( )
A.反应4HCl(g)+O2(g)2Cl2(g)+2H2O(l)的ΔH>-116 kJ·mol-1
B.a>1, b>2
C.p2=1.6×105 Pa, p3=4×105 Pa
D.若起始向容器Ⅰ中充入0.5 mol HCl、0.5 mol O2、0.5 mol Cl2和0.5 mol H2O,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA 表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,4gH2含有的分子数为2NA
B.17g氨气所含电子数目为8NA
C.将1体积c1mol/L的硫酸溶于4体积水中 ,稀溶液的浓度为0.2c1mol/L
D.将5.85gNaCl 晶体溶入100mL水中,制得0.1mol/L的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Fe2(SO4)3、CuCl2混和溶液中投入足量的铁粉充分反应后,得到的固体经过滤、干燥、称重,若所得固体的质量与加入的铁粉的质量相等,则原溶液中c(SO42-)与c(Cl-)之比为
A.3︰14B.1︰7C.2︰7D.3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组同学为探究锌与硫酸反应生成SO2、H2的临界浓度(浓硫酸能与锌反应生成SO2的最低浓度)设计了如下实验。在大试管A中加入100mLl 8mol/L硫酸,向连接在塑料棒上的多孔塑料球内加入足量的锌粒(塑料棒可以上下移动),在试剂瓶D中加入足量的浓NaOH溶液(加热和夹持装置已省略)。

已知:锌与浓硫酸接触,开始时反应缓慢,可以适当加热以加速其反应,当有大量气泡生成时,该反应速率会明显加快并伴有大量的热放出。
(1)请写出锌与硫酸反应产生SO2的化学方程式______________。
(2)在组装仪器之后,加入试剂之前必须进行的操作是__________。
(3)长导管B的作用是______,如果没有这个设计,最终测定的临界浓度会_________。(填“偏高”、“偏低"或“无影响”)
(4)装置中干燥管C的作用是_______,请简述如何判断硫酸已达临界浓度________。
(5)反应结束后向D装置中加入足量的H2O2溶液和足量的BaCl2溶液,充分反应后将所得沉淀过滤、洗涤、干燥、称量得到固体质量为a克,则浓硫酸与锌反应的临界浓度为:_________mol/L。(用含a的计算式表示,忽略体积变化)
(6)某同学通过联系氧化还原反应的相关知识,认为也可以利用硫酸酸化的高锰酸钾溶液对D中的SO32-进行滴定,通过滴定出的SO32-的物质的量计算临界浓度,你认为他的这一想法是否可行?________(填“可行”或“不可行”),原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y混合气体在密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
cZ(g) ΔH<0;达到化学平衡后,测得X气体的浓度为0.5 mol/L;恒温条件下将密闭容器的容积扩大一倍并再次达到平衡时,测得X气体的浓度为0.3 mol/L。则下列叙述正确的是
A.平衡向右移动 B.a+b>c
C.Y的转化率提高 D.Z的体积分数增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学源于生活,在生产生活中,我们会遇到各种各样的化学反应。
(1)过氧化钠用于潜水艇或呼吸面具做供氧剂,主要反应的化学方程式为:_____。
(2)工业上用电解饱和食盐水的方法生产氯气,即“氯碱工业”,写出反应的化学方程式:_____。
(3)野外作业中用于焊接铁轨,该反应的化学方程式为:_____。
(4)将一个铝制易拉罐充满CO2气体,然后往罐内注入足量的NaOH溶液,立即密封罐口,过一段时间后,罐壁内凹而瘪,再过一段时间后又重新鼓起。试用离子方程式解释易拉罐又重新鼓起的原因______。
(5)用小苏打治疗胃酸过多,反应的离子方程式为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用SO2还原MnO2制备MnSO4的装置如图所示,下列说法正确的是( )
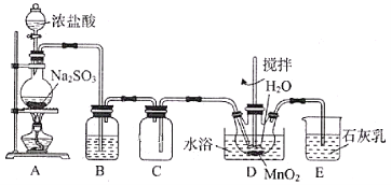
A.装置B中试剂可为Na2SO3溶液,其作用是除去SO2中的HCl
B.装置D中水浴温度应控制在80℃左右,温度过高时反应速率可能减慢
C.将装置D中所得MnSO4溶液蒸干可获得纯净的MnSO4·H2O
D.装置E中发生反应的离子方程式为SO2+2OH-=SO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2020年2月,科学家报道了利用磁性纳米Fe3O4颗粒除去水体草甘膦污染物的方法,其原理如下图所示:(Fe3O4颗粒在水中表面会带-OH,在水体pH≈4时除污效果最好)。下列说法不正确的是

A.草甘膦既可以和盐酸反应,又可以和氢氧化钠溶液反应
B.Fe3O4纳米颗粒除去草甘膦的过程有化学键的形成和断裂
C.Fe3O4纳米颗粒粒径越小、水体pH越大除污效果越好
D.处理完成后,Fe3O4纳米颗粒可利用磁铁回收,经加热活化重复使用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com