
����Ŀ��ij�о�С��ͬѧΪ̽��п�����ᷴӦ����SO2��H2���ٽ�Ũ��(Ũ��������п��Ӧ����SO2�����Ũ��)���������ʵ�顣�ڴ��Թ�A�м���100mLl 8mol/L���ᣬ�����������ϰ��ϵĶ���������ڼ���������п��(���ϰ����������ƶ�)�����Լ�ƿD�м���������ŨNaOH��Һ(���Ⱥͼг�װ����ʡ��)��

��֪��п��Ũ����Ӵ�����ʼʱ��Ӧ�����������ʵ������Լ����䷴Ӧ�����д�����������ʱ���÷�Ӧ���ʻ����Լӿ첢���д������ȷų���
(1)��д��п�����ᷴӦ����SO2�Ļ�ѧ����ʽ______________��
(2)����װ����֮�����Լ�֮ǰ������еIJ�����__________��
(3)������B��������______�����û�������ƣ����ղⶨ���ٽ�Ũ�Ȼ�_________��(����ƫ��������ƫ��"������Ӱ����)
(4)װ���и����C��������_______�����������ж������Ѵ��ٽ�Ũ��________��
(5)��Ӧ��������Dװ���м���������H2O2��Һ��������BaCl2��Һ����ַ�Ӧ�����ó������ˡ�ϴ�ӡ���������õ���������Ϊa�ˣ���Ũ������п��Ӧ���ٽ�Ũ��Ϊ��_________mol/L��(�ú�a�ļ���ʽ��ʾ����������仯)
(6)ijͬѧͨ����ϵ������ԭ��Ӧ�����֪ʶ����ΪҲ�������������ữ�ĸ��������Һ��D�е�SO32-���еζ���ͨ���ζ�����SO32-�����ʵ��������ٽ�Ũ�ȣ�����Ϊ������һ�뷨�Ƿ����?________(����������������������)��ԭ����__________��
���𰸡�Zn+2H2SO4(Ũ)=ZnSO4+SO2��+2H2O ����װ�������� �������������� ƫ�� ������ ��F���ռ����岢�鴿�����ȷ���ռ�����������֤������Ũ���Ѿ������ٽ������ 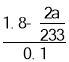 ������ ʵ������в��ܱ�֤�õ���Na2SO3��Һ�Ƿ�ᱻ�����е������������ʣ���ɵζ������ȷ
������ ʵ������в��ܱ�֤�õ���Na2SO3��Һ�Ƿ�ᱻ�����е������������ʣ���ɵζ������ȷ
��������
���ʵ��̽��п�����ᷴӦ����SO2��H2���ٽ�Ũ�ȣ���Ϊ��װ����һ�����巢��װ�ã�����װ����֮����װ������֮����װ�������ԣ�����������п��Ӧ���ɶ�����������Ũ�ȣ����ٽ�Ũ�ȣ��ⶨ�Ӷ�����������ʵ���������Zn+2H2SO4(Ũ)=ZnSO4+SO2��+2H2O�ķ���ʽ�����������һ�����Ķ���������Ҫ���ĵ����ᣬ����������ʵ�����ȥ����һ���������������ĵ���������ʵ����������ʣ����������ʵ���������c=![]() ����������ղⶨ������ٽ�Ũ�ȡ�
����������ղⶨ������ٽ�Ũ�ȡ�
��1���տ�ʼ�����Ũ�ȱȽϴ���п��Ӧ���ɶ��������䷴Ӧ����ʽΪZn+2H2SO4(Ũ)=ZnSO4+SO2��+2H2O��
��2����װ����һ�����巢��װ�ã�����װ����֮���װ�õ������ԣ������������ã��ټ���ҩƷ��
��3���÷�Ӧ�Ǹ����ȷ�Ӧ��������B�������ǵ��������������ã�ʹˮ������������������ȷ��������Һ�������������ã����û�������ƣ����ղⶨ���ٽ�Ũ�Ȼ�ƫ�ͣ�
��4��������������Ⱦ���岻���ŷŵ������У���Ҫ������������Һ���գ����ø����C��ֹҺ�巢���������ж������Ѵ��ٽ�Ũ��:���ݷ�Ӧһ��ʱ�䣬Ũ�����Ϊϡ���ᣬϡ������п��Ӧ�������ɶ�����������������������F���ռ����岢�鴿�����ȷ���ռ�����������֤������Ũ���Ѿ������ٽ�����£�
��5������������H2O2��Һ��������������Ϊ�����ƣ�����������BaCl2��Һ�������ᱵ��������ַ�Ӧ�����ó������ˡ�ϴ�ӡ���������õ���������Ϊa�ˣ�n(BaSO4)=![]() ��n(SO2)=
��n(SO2)=![]() ��������������ʵ���Ϊ��n(H2SO4) =n(SO2)=2��
��������������ʵ���Ϊ��n(H2SO4) =n(SO2)=2��![]() ��Zn+2H2SO4(Ũ)=ZnSO4+SO2��+2H2O��Ũ������п��Ӧ���ٽ�Ũ��Ϊ��
��Zn+2H2SO4(Ũ)=ZnSO4+SO2��+2H2O��Ũ������п��Ӧ���ٽ�Ũ��Ϊ��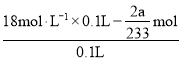 =
=
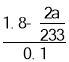 mol/L��
mol/L��
��6�������������ữ�ĸ��������Һ��D�е�SO32-���еζ�����Ϊ�ڵζ��Ĺ�������Һ�е�����������ӻᱻ�����е���������Ϊ��������ӣ���ɵζ������ȷ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У�һ�������£��������·�Ӧ��NO(g)��CO(g) ![]()
![]() N2(g)+CO2(g)����H= -373.2kJ/mol���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ��
N2(g)+CO2(g)����H= -373.2kJ/mol���ﵽƽ���Ϊ��߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ����ȷ��ʩ��
A.�Ӵ���ͬʱ�����¶�B.�Ӵ���ͬʱ����ѹǿ
C.�����¶�ͬʱ����N2D.�����¶�ͬʱ����ѹǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2L���ܱ������У�X�� Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ��

����������ȷ���ǣ� ��
A. ��Ӧ��ʼ��10s����Z��ʾ�ķ�Ӧ����Ϊ0.158mol/(L��s)��1
B. ��Ӧ��ʼ��l0s��X�����ʵ���Ũ�ȼ�����0.79mol/L
C. ��Ӧ��ʼ��10sʱ��Y��ת����Ϊ79.0%
D. ��Ӧ�Ļ�ѧ����ʽΪ��X(g)��Y(g)![]() Z(g)
Z(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��W��X��Y��Z��ԭ��������������X��ԭ�Ӱ뾶�����ж���������Ԫ�������ģ�W�ĺ����������X��Z������������֮����ȣ�Y��ԭ��������Z��������������2������W��X��Y����Ԫ���γɵĻ�����M�Ľṹ��ͼ��ʾ������������ȷ����

A.Y���ʵ��۵����X����
B.Ԫ�طǽ�����ǿ����˳��ΪW>Y>Z
C.ZԪ������Ȼ���м�������̬Ҳ�л���̬
D.1moIW ��X�γɵĻ������п��ܺ���4mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2��g��+O2��g��=2SO3��g����Ӧ���̵������仯��ͼ��ʾ����֪1mol SO2��g������Ϊ1molSO3��g������H=-99kJ��mol��1����ش��������⣺
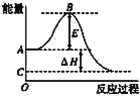
��1��ͼ��A��C�ֱ��ʾ____��___��E�Ĵ�С�Ը÷�Ӧ�ķ�Ӧ��__����С����ޡ���Ӱ�졣�÷�Ӧͨ����V2O5����������V2O5��ʹͼ��B��___������ߡ����͡�������H___��������С�����䡱����
��2��ͼ����H=____kJ��mol��1��
��3��������ʵ��д�����з�Ӧ���Ȼ�ѧ����ʽ��
��1molN2(g)������H2(g)��Ӧ������NH3(g)���ų�92.2kJ������_____��
��1molCu(s)������O2(g)��Ӧ������CuO(s)���ų�157kJ������_____��
����25�桢101kPaʱ��8 g CH4��ȫȼ������Һ̬ˮʱ�ų���������445.15kJ����CH4ȼ�յ��Ȼ�ѧ����ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݵ���������Ӧ���Ȼ�ѧ����ʽ�������ж���ȷ����
��I2(g)��H2(g) ![]() 2HI(g)����H����9.48 kJ/mol
2HI(g)����H����9.48 kJ/mol
��I2(s)��H2(g) ![]() 2HI(g)����H����26.48 kJ/mol
2HI(g)����H����26.48 kJ/mol
A. 254 g I2(g)��ͨ��2 g H2(g)����Ӧ����9.48 kJ
B. 1 mol��̬����1 mol��̬�������������17.00 kJ
C. ��Ӧ�ڵķ�Ӧ���������ȷ�Ӧ�ٵķ�Ӧ����������
D. ����Ӧ������52.96 kJ����ʱת��2 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ų��ķ�ˮ�к��д�����Fe2+��Cu2+��SO42-��
��.ijУ�о���ѧϰС�������ͼ�����Ի���ͭ��������������ش�
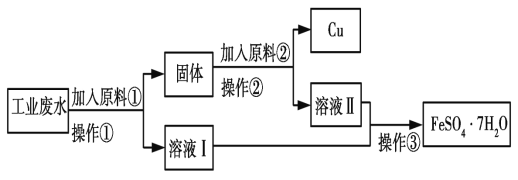
��1����Ӧ�ٵ����ӷ���ʽΪ______��
��2�����������õ��IJ���������_____(�����)��
a���ձ� b��©�� c�������� d���ƾ���
��3������ɷ���_____��(������)��
��4��ԭ�Ϣڵ�����Ϊ_____��
��.���յ�ͭ�������Ʊ�����(CuSO4��5H2O)����ͭ��һ��Ũ��ϡ�����Ϻ��ڼ��ȵ������ͨ���������������·�Ӧ��2Cu��2H2SO4��O2![]() 2CuSO4��2H2O�� �Ƶ�����ͭ��Һ��������Ũ������ȴ�ᾧ�����˿ɵõ�����
2CuSO4��2H2O�� �Ƶ�����ͭ��Һ��������Ũ������ȴ�ᾧ�����˿ɵõ�����
��1�������2Cu��2H2SO4��O2![]() 2CuSO4��2H2O��Ӧ�У���������_____������������____(�ѧʽ)��
2CuSO4��2H2O��Ӧ�У���������_____������������____(�ѧʽ)��
��2����˫���ű��������Ӧ�ĵ��ӵ�ʧ_____��
2Cu��2H2SO4��O2![]() 2CuSO4��2H2O
2CuSO4��2H2O
��3������147gH2SO4 ���뷴Ӧ����ת�Ƶĵ�����ĿΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������������100 mL 0.01 mol/L��ϡ���ᷴӦ����Ӧ����̫����Ϊ�˼ӿ�˷�Ӧ���ʶ����ı�H2�IJ���������ʹ�����·����е�______��(�����)
�ټ�H2O���ڼ�NaOH���塡�۵��뼸��Ũ���� �ܼ�CH3COONa���塡�ݼ�NaCl��Һ�����뼸������ͭ��Һ���������¶�(����������ӷ�)�������10 mL 0.1 mol/L����
��2�����п���֤��H2(g)��I2(g) ![]() 2HI(g)�Ѵ�ƽ��״̬����______��(�����)
2HI(g)�Ѵ�ƽ��״̬����______��(�����)
�ٵ�λʱ��������n mol H2��ͬʱ������n mol HI
��һ��H��H�����ѵ�ͬʱ������H��I������
�۰ٷֺ���w(HI)��w(I2) �ܷ�Ӧ����v(H2)��v(I2)��v(HI)
��c(HI)��c(H2)��c(I2)��2��1��1
���¶Ⱥ����һ��ʱ��������Ũ�Ȳ��ٱ仯
���¶Ⱥ����һ��ʱ��������ѹǿ���ٱ仯
���¶Ⱥ����һ��ʱ��������������ɫ���ٱ仯
������һ������������ƽ����Է����������ٱ仯
��3����֪���з�Ӧ��ƽ�ⳣ������H2(g)��S(s) ![]() H2S(g)��K1��
H2S(g)��K1��
��S(s)��O2(g) ![]() SO2(g)��K2����ӦH2(g)��SO2(g)
SO2(g)��K2����ӦH2(g)��SO2(g) ![]() O2(g)��H2S(g)��ƽ�ⳣ����______������K1��K2 �Ĵ���ʽ��ʾ��
O2(g)��H2S(g)��ƽ�ⳣ����______������K1��K2 �Ĵ���ʽ��ʾ��
��4����֪����2C(s)��O2(g)===2CO(g)����H����221.0 kJ/mol
��2H2(g)��O2(g)===2H2O(g)����H����483.6 kJ/mol
���Ʊ�ˮú���ķ�ӦC(s)��H2O(g)===CO(g)��H2(g)����HΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ��
��![]() ��
��![]() ������ȣ��ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������н��з�Ӧ��
������ȣ��ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������н��з�Ӧ��![]() ���õ������������ݣ�����ʵ��١���û��ʹ�ô���������˵������ȷ���ǣ� ��
���õ������������ݣ�����ʵ��١���û��ʹ�ô���������˵������ȷ���ǣ� ��
ʵ�� | �¶�/�� | ��ʼ | ƽ�� | ��ƽ������ʱ��/min |
�� | 500 | 5.00 | 2.00 | 40 |
�� | 800 | 3.00 | 1.00 | 15 |
�� | 500 | 3.00 | 1.20 | 9 |
A. ʵ����У���![]() �ڣ���
�ڣ���![]() ��ʾ�ķ�Ӧ���ʴ���
��ʾ�ķ�Ӧ���ʴ���![]()
B. �Ƚ�ʵ��ٺ͢ڣ�����˵��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
C. �Ƚ�ʵ��ٺ͢ڣ�����˵����Ӧ�������¶����߶�����
D. �Ƚ�ʵ��ںۣ͢�˵��ʵ���ʹ���˴���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com