
【题目】某校化学探究小组利用以下装置制取并探究氨气的性质。[已知生石灰与水反应生成Ca(OH)2并放出热量,实验室利用此原理往生石灰中滴加浓氨水,可以快速制取氨气。部分夹持仪器已略去]
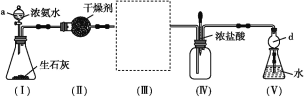
(实验探究)
(1)装置(Ⅰ)中生石灰的化学式为________,仪器a的名称是_____。
(2)装置(Ⅱ)中的干燥剂可选用____(填“碱石灰”或“浓硫酸”)。
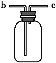
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气应从导管口_____(填“b”或“c”)通入集气瓶中。
(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,可观察到瓶内产生大量的______(填“白烟”或“白雾”),写出NH3与HCl反应的化学方程式:___________。
(5)装置(Ⅴ)中仪器d的作用是_______。取装置(Ⅴ)中的少量氨水于试管中,滴入1~2滴酚酞试液,溶液显____(填“无色”或“红色”),其原因是_______。
(知识应用)
(6)液氨可作制冷剂是由于液氨汽化时_____(填“吸收”或“放出”)大量的热,使周围环境的温度降低。
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+5O2![]() 4NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
4NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
【答案】CaO 分液漏斗 碱石灰 c 白烟 NH3+HCl=NH4Cl 防止溶液倒吸 红色 氨水显碱性(或NH3·H2O![]() NH4++OH-等) 吸收 升高 还原性
NH4++OH-等) 吸收 升高 还原性
【解析】
(1)装置(Ⅰ)中生石灰的化学名是氧化钙,化学式为CaO,仪器a的名称是分液漏斗。
答案为:CaO;分液漏斗;
(2)装置(Ⅱ)中的干燥剂为固体干燥剂,应选用碱石灰。
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气通入集气瓶中应该短进长出,进口为c。
答案为:c;
(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,浓盐酸具有挥发性,在瓶内与氨气化合生成氯化铵固体小颗粒,可观察到瓶内产生大量的白烟, NH3与HCl反应的化学方程式:NH3+HCl=NH4Cl。
答案为:白烟;NH3+HCl=NH4Cl
(5)氨气极易溶于水,会发生倒吸,装置(Ⅴ)中仪器d的作用是防止溶液倒吸。取装置(Ⅴ)中的少量氨水于试管中,滴入1~2滴酚酞试液,由于氨水是弱碱,溶液显碱性,与酚酞变红。
答案为:红色;氨水显碱性(或NH3·H2O![]() NH4++OH-等);
NH4++OH-等);
(6)液氨可作制冷剂是由于液氨汽化时吸收大量的热,使周围环境的温度降低。
答案为:吸收;
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+5O2![]() 4NO+6H2O,在该反应中氮元素的化合价-3价变为+2价,化合价升高,氨气是还原剂,表现出还原性。
4NO+6H2O,在该反应中氮元素的化合价-3价变为+2价,化合价升高,氨气是还原剂,表现出还原性。
答案为:升高;还原性


科目:高中化学 来源: 题型:
【题目】某小组在研究前18号元素时发现:依据不同的标准和规律,元素周期表有不同的排列形式。如果将它们按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“”代表一种元素,其中P点代表氢元素。下列说法不正确的是( )
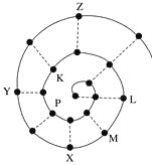
A. 图中虚线相连的元素位于同一族
B. P、K、L、M、X、Y、Z都是短周期元素
C. K元素位于常规周期表的第三周期第ⅥA族
D. M与Z 两种元素形成的化合物的化学式为MgCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物M的合成路线如下图所示:

已知:
(以上R、R’、R’’代表氢、烷基或芳基等)
(1)C中官能团名称为__________,B的化学名称为____________。
(2)F的结构简式为___________,则与F具有相同官能团的同分异构体共_____种(考虑顺反异构,不包含F)。
(3)由G生成H的化学方程式为________________________,反应类型为____________。
(4)下列说法正确的是________________(选填字母序号)。
a.由H生成M的反应是加成反应
b.可用硝酸银溶液鉴别B、C两种物质
c.1 mol E最多可以与4 mol H2发生加成反应
d.1 mol M与足量NaOH溶液反应,消耗4 mo1 NaOH
(5)以乙烯为起始原料,结合已知信息选用必要的无机试剂,写出合成CH3CH=CHCH3的路线________________ (用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色。下列正确的是
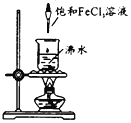
A.在暗处用激光笔照射液体,会出现一条光亮的通路
B.可用滤纸分离提纯得到氢氧化铁胶体
C.所得胶体中分散质的粒子直径大于100nm
D.取适量液体置于U型管,并通直流电,阳极颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. H2+Cl2![]() 2HCl
2HCl
B. CuO+H2SO4=CuSO4+H2O
C. 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
D. MgCl2+2NaOH=Mg(OH)2↓+2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学为了测定工业纯碱的纯度,进行了一系列实验。
(1)和索氏制碱法相比,侯氏制碱法的优势有___________________________________;
(2)工业纯碱中常含有少量NaCl杂质,解释原因__________________________,检验是否含有氯化钠杂质的方法为__________________________________________________________;
(3)使用重量法测定纯碱的纯度,用到的试剂有__________________________________;
(4)使用滴定法测定纯碱的纯度,用_________________(填仪器名称)称量1.200g工业纯碱样品,溶解,用1mol/L盐酸做标准液,滴定过程中溶液pH变化和生成CO2的量如图所示,A点溶液呈碱性的原因______________________________________________________,计算该工业纯碱样品的质量分数_______________。(计算结果保留两位小数)
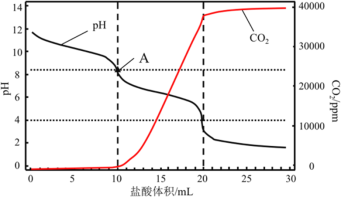 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体NH4Br置于密闭容器中,在某温度下,发生反应:NH4Br(s)![]() NH3(g)+HBr(g),2HBr(g)
NH3(g)+HBr(g),2HBr(g)![]() Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
Br2(g)+H2(g),2 min后,测知H2的浓度为0.5 mol·L-1,HBr的浓度为4 mol·L-1,若上述反应速率用v(NH3)表示,则下列速率正确的是( )
A. 0.5 mol·L-1·min-1B. 2.5 mol·L-1·min-1
C. 2 mol·L-1·min-1D. 1.25 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国许多城市为了减少燃煤造成的大气污染,对煤做了多方面的改进:
(1)为了除去煤中的含硫化合物,采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生反应如下:FeS2+14FeCl3+8H2O====2FeSO4+13FeCl2+16HCl(已知FeS2中硫元素的化合价为-1价)。
①该反应的氧化剂是____,若有1 mol FeS2被除去,则发生转移的电子的物质的量是___________。
②为了充分利用Fe2+并减少酸(HCl)污染,本方法中可利用工业废铁屑和Cl2让废液重新生成FeCl3。请写出这一过程中有关的离子方程式:______________;_____________________。
(2)“保护环境,就是保护人类自己”。飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气的污染物二氧化硫(SO2)接触时,二氧化硫(SO2)会部分转化为三氧化硫(SO3),其污染更加严重。
①飘尘所起的作用可能是______________.
A. 氧化剂B.还原剂C.催化剂D.载体
发生反应的化学方程式为________________________________________________.(如果是氧化还原反应,请用双线桥标出电子转移的方向和数目)
②冶金工业中常用高压电对气溶胶作用,以除去飘尘,减少对空气的污染,这种做法的依据是___.
A. 布朗运动 B.丁达尔现象 C. 渗析 D. 电泳。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积(mol2·L-2) | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a___1×10-14 (填“>”、“<”或“=”![]() ,作此判断的理由是___。
,作此判断的理由是___。
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=____。
(3)在t2℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)水=___
(4)t2℃下,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L(混合体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___,此溶液中各种离子的浓度由大到小的排列顺序:____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com