
【题目】我国许多城市为了减少燃煤造成的大气污染,对煤做了多方面的改进:
(1)为了除去煤中的含硫化合物,采用FeCl3脱硫,即用FeCl3溶液浸洗煤粉,发生反应如下:FeS2+14FeCl3+8H2O====2FeSO4+13FeCl2+16HCl(已知FeS2中硫元素的化合价为-1价)。
①该反应的氧化剂是____,若有1 mol FeS2被除去,则发生转移的电子的物质的量是___________。
②为了充分利用Fe2+并减少酸(HCl)污染,本方法中可利用工业废铁屑和Cl2让废液重新生成FeCl3。请写出这一过程中有关的离子方程式:______________;_____________________。
(2)“保护环境,就是保护人类自己”。飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降,它与空气的污染物二氧化硫(SO2)接触时,二氧化硫(SO2)会部分转化为三氧化硫(SO3),其污染更加严重。
①飘尘所起的作用可能是______________.
A. 氧化剂B.还原剂C.催化剂D.载体
发生反应的化学方程式为________________________________________________.(如果是氧化还原反应,请用双线桥标出电子转移的方向和数目)
②冶金工业中常用高压电对气溶胶作用,以除去飘尘,减少对空气的污染,这种做法的依据是___.
A. 布朗运动 B.丁达尔现象 C. 渗析 D. 电泳。
【答案】FeCl3 14mol Fe+2H+=Fe2++H2↑ 2Fe2++Cl2=2Fe3++2Cl- C  D
D
【解析】
(1)在反应 FeS2+14FeCl3+8H2O==2FeSO4+13FeCl2+16HCl中,FeS2中S由-1价升高到+6价,Fe的+2价不变,FeCl3中,Fe由+3价降低到+2价。
①该反应的氧化剂是含有化合价降低元素的反应物,若有1 mol FeS2被除去,则发生转移的电子的物质的量是2mol×7。
② 加入Fe粉后,Fe与HCl反应,生成的FeCl2再被Cl2氧化。
(2) ①飘尘所起的作用是加快SO2转化为SO3的反应速率。
②冶金工业中常用高压电对气溶胶作用,以除去飘尘,利用胶粒在直流电作用下能做定向移动的性质。
(1)在反应 FeS2+14FeCl3+8H2O==2FeSO4+13FeCl2+16HCl中,FeS2中S由-1价升高到+6价,Fe的+2价不变,FeCl3中,Fe由+3价降低到+2价。
①该反应的氧化剂是含有化合价降低元素的FeCl3,若有1 mol FeS2被除去,则发生转移的电子的物质的量是2mol×7=14mol。答案为:FeCl3;14mol;
② 加入Fe粉和Cl2后,发生反应的离子方程式为:Fe+2H+=Fe2++H2↑,2Fe2++Cl2=2Fe3++2Cl-。答案为:Fe+2H+=Fe2++H2↑;2Fe2++Cl2=2Fe3++2Cl-;
(2) ① 飘尘所起的作用是加快SO2转化为SO3的反应速率,因而是催化剂作用,应选C;双线桥表示的电子转移方向和数目为 。答案为:C;
。答案为:C; ;
;
②冶金工业中常用高压电对气溶胶作用,以除去飘尘,这种做法的依据是D。答案为:D。


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】已知a、b、c的分子式均为C9H10O2,结构简式如图所示。下列说法正确的是( )
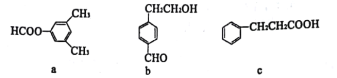
A.a、b、c都能与Na反应产生H2
B.a、b、c分子中所有碳原子可能共平面
C.b与c在浓硫酸加热条件下可以发生缩聚反应
D.c苯环上的一氯代物和二氯代物分别为3种和4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学探究小组利用以下装置制取并探究氨气的性质。[已知生石灰与水反应生成Ca(OH)2并放出热量,实验室利用此原理往生石灰中滴加浓氨水,可以快速制取氨气。部分夹持仪器已略去]
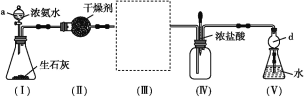
(实验探究)
(1)装置(Ⅰ)中生石灰的化学式为________,仪器a的名称是_____。
(2)装置(Ⅱ)中的干燥剂可选用____(填“碱石灰”或“浓硫酸”)。
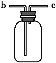
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气应从导管口_____(填“b”或“c”)通入集气瓶中。
(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,可观察到瓶内产生大量的______(填“白烟”或“白雾”),写出NH3与HCl反应的化学方程式:___________。
(5)装置(Ⅴ)中仪器d的作用是_______。取装置(Ⅴ)中的少量氨水于试管中,滴入1~2滴酚酞试液,溶液显____(填“无色”或“红色”),其原因是_______。
(知识应用)
(6)液氨可作制冷剂是由于液氨汽化时_____(填“吸收”或“放出”)大量的热,使周围环境的温度降低。
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+5O2![]() 4NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
4NO+6H2O,在该反应中氮元素的化合价____(填“升高”或“降低”),氨气表现出_____(填“氧化性”或“还原性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验事实的解释错误的是( )
选项 | 实验事实 | 解释 |
A | 实验室用粗锌与稀盐酸反应制H2比纯锌快 | 粗锌与稀盐酸构成原电池 |
B | 浓硝酸保存在棕色试剂瓶中 | 4HNO3 |
C | 向10mL0.2mol·L-1ZnSO4,溶液中加入10mL0.4mol·L-1Na2S溶液,产生白色沉淀,再滴加CuSO4溶液,沉淀变黑 | Ksp(CuS)<Ksp(ZnS) |
D | 做过银镜反应的试管可用铁盐溶液洗涤,加入稀盐酸,清洗效果更好 | Fe3++Ag |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以左右自由滑动的隔板(其质量忽略不计).其中能表示相同温度时,等质量的氢气与氦气的是( )
A. B.
B.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的少D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼烯具有优异的电学、力学、热学等属性,将成为继石墨烯之后又一种“神奇纳米材料”。科学家已成功合成多种结构的硼烯,如图为“皱褶”式硼烯的结构。下列说法错误的是( )

A.“皱褶”式硼烯中每个硼原子共用3对电子
B.“皱褶”式硼烯中硼原子达到8电子稳定结构
C.硼烯有望代替石墨烯作电极材料
D.氧化硼的水化物是一种弱酸,与过量OH-反应可生成B(OH)4-或BO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1 mol·L-1 NaHCO3溶液中:NH![]() 、H+、NO
、H+、NO![]() 、SO
、SO![]()
B.使酚酞变红色的溶液中:Mg2+、Fe2+、NO![]() 、Cl-
、Cl-
C.0.1 mol·L-1 FeCl3溶液中:K+、Na+、Br-、SCN-
D.c(H+)=1×10-4 mol·L-1的溶液中:K+、Cu2+、Cl-、SO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com