
科目: 来源: 题型:
【题目】如图是中国在南极建设的第四个科学考察站——泰山站。为了延长科学考察站基础设施使用寿命,钢铁设备表面镶嵌一些金属块(M)。下列说法正确的是

A. 金属块M可能是铜,发生氧化反应
B. 这种保护方法叫牺牲阳极的阴极保护法
C. 科考考察站里的设备在潮湿空气中主要发生化学腐蚀
D. 若采用外加电流的阴极保护法,设备与电源正极相连
查看答案和解析>>
科目: 来源: 题型:
【题目】钴(Co)是生产耐热合金、硬质合金、防腐合金、磁性合金和各种钴盐的重要原料,其金属性弱于 Fe 强于 Cu。某低位硫钴铜矿的成分为:CoS、CuFeS2、CaS、SiO2, 一种利用生物浸出并回收其中钴和铜的工艺流程如图:
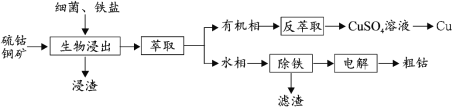
回答下列问题:
(1)Cu2+的生物浸出原理如下:
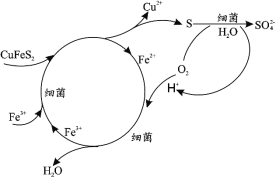
温度超过 50℃浸出率急剧下降,其原因是_____;其他金属离子的浸出原理与上图类似, 写出由 CoS 浸出 Co2+的离子方程式_____。
(2)浸出渣的主要成分为_____。
(3)萃取分离铜的原理如下:Cu2++2(HR)org![]() (CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(4)除铁步骤中加入 H2O2,调节溶液的 pH 至 4,将 Fe2+转化为 FeOOH 过滤除去,写出该转化的离子方程式为_____。检验 Fe2+是否完全被转化的试剂为_____。
(5)通过电解法制得的粗钴含有少量铜和铁,需要电解精炼,进行精炼时,精钴应处于_____极(填“阴”或“阳”),阳极泥的主要成分为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲基砜是合成人体胶原蛋白的必要物质。实验室用二甲基硫醚为原料合成二甲基砜的新方法为:
反应 i:(CH3)2S+H2O2→(CH3)2SO+H2O
反应 ii: 。
二甲基硫醚(CH3)2S | 二甲基亚枫(CH3)2SO | 二甲基砜(CH3)2SO2 | |
密度 | 0.85 g·cm-3 | 1.10 g·cm-3 | —— |
熔点/沸点 | -83.2℃/37.5℃ | 18.4℃/189℃ | 111℃/238℃ |
溶解性 | 不溶于水 | 易溶于水、乙醇 | 易溶于水、乙醇 |
具体流程如下:
![]()
回答下列问题:
(1)反应装置如图所示,仪器 B 的名称是_____,其作用是_____。
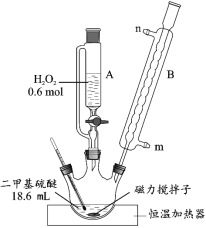
(2)第①步反应温度不高于 40 ℃的原因是_____;该步骤反应完全的现象是_____。
(3)第②步先将 A 中滴加剩余的 H2O2 全部加入三颈烧瓶中,然后加热发生反应 ii。该反应的化学方程式为_____。
(4)第③步的实验操作为_____、过滤、低温干燥,得到二甲基砜产品。
(5)二甲基砜传统的生产工艺是由 HNO3 氧化(CH3)2S 生成(CH3)2SO,然后用 NaOH 中和、精馏,制得精品(CH3)2SO,最后再经氧化制得(CH3)2SO2。该新方法与传统硝酸氧化法比的优点有_____(至少回答 2 点)。
(6)该实验中制得二甲基砜 19.176g。二甲基砜的产率为_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。D能与碳酸钠反应产生气体,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。
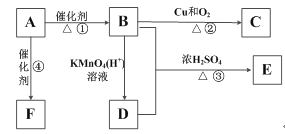
(1)A的结构简式为_____。
(2)B分子中的官能团名称是_____,F的结构简式为_______________。
(3)写出下列反应的化学方程式并指出反应类型:
②_____________________________________________:反应类型是_____;
③_____________________________________________;反应类型是_____;
查看答案和解析>>
科目: 来源: 题型:
【题目】nL三种气态烃混合物与足量氧气混合点燃后,恢复到原来状态(常温常压),体积共缩小2nL,这三种烃不可能的组合是( )
A. CH4、C2H4、C3H4以任意比混合
B. C3H8、C4H8、C2H2以11:14:26的质量之比混合
C. CH4、C2H2、C3H6以1:2:2的体积比混合
D. C2H6、C4H6、C2H2以2:1:2的物质的量之比混合
查看答案和解析>>
科目: 来源: 题型:
【题目】某些难溶性铅盐可用作涂料,如秦俑彩绘中使用的铅白(PbCO3)和黄金雨中黄色的PbI2。室温下,PbCO3 和 PbI2 在不同的溶液中分别达到溶解平衡时-lgc(Pb2+)与-lgc(CO32-)或-lgc(I-)的关系如图所示。下列说法错误的是
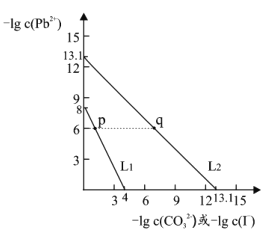
A.Ksp(PbCO3)的数量级为 10-14
B.相同条件下,水的电离程度 p 点大于 q 点
C.L1 对应的是-lgc(Pb2+)与-lgc(I-)的关系变化
D.p 点溶液中加入 Na2CO3 浓溶液,可得白色沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家在太阳能可规模化分解水制氢方面取得新进展——率先提出并验证了一种全新的基于粉末纳米颗粒光催化剂太阳能分解水制氢的“氢农场”策略,其太阳能光催化全分解水制氢的效率创国际最高记录(示意图如图所示,M1、M2 为含铁元素的离子)。下列说法正确的是
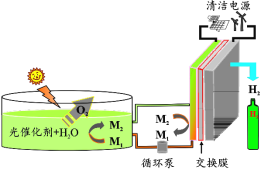
A.制 O2 装置中,太阳能转化为电能
B.制 H2 装置中,交换膜为阴离子交换膜
C.系统制得1mol H2的同时可制得 1mol O2
D.制H2时阳极可发生反应:[Fe(CN)6]4––e- = [Fe(CN)6]3–
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组利用如图装置制备 NH3 并探究其性质。下列说法正确的是

A.①中固体可换为 NH4Cl
B.②中药品为 P2O5
C.反应一段时间后,③中黑色固体变为红色
D.反应一段时间后,④中锥形瓶收集到液氨
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可反应生成溴苯和溴化氢,此反应为放热反应,他们用图装置制取溴苯,先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(此时A下端活塞关闭)中。
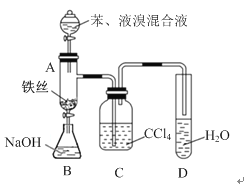
(1)写出A中反应的化学方程式__________________;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_________,写出有关的离子方程式____________________;生成的有机物物位于溶液______层(填“上”或“下”)。
(3)C中盛放CCl4的作用是______________________;
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生________,则能证明;另一种验证的方法是向试管D滴加_____________,溶液变红色则能证明。
查看答案和解析>>
科目: 来源: 题型:
【题目】2016年度国家科学技术奖授予我国诺贝尔奖获得者屠呦呦,表彰她在抗疟疾青蒿素方面的研究。
(查阅资料)青蒿素熔点156~157℃,易溶于丙酮、氯仿和乙醚,在水几乎不溶。
I.实验室用乙醚提取青蒿素的工艺流程如下:

(1)在操作I前要对青蒿进行粉碎,其目的是________________
(2)操作II的名称是_____________。
(3)操作III进行的是重结晶,其操作步骤为_____ 、_____、______、过滤、洗涤、干燥
II.已知青蒿素是一种烃的含氧衍生物为确定它的化学式,进行了如下实验:

实验步骤:①连接装置,检查装置的气密性。②称量E、F中仪器及药品的质量。③取14.10g青蒿素放入硬质试管C中,点燃C、D处酒精灯加热,充分燃烧④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(4)装置E、F应分别装入的药品为_______________、___________________。
(5)实验测得:
装置 | 实验前 | 实验后 |
E | 24.00g | 33.90g |
F | 100.00g | 133.00g |
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为______。
(6)若使用上述方法会产生较大实验误差,你的改进方法是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com