
【题目】钴(Co)是生产耐热合金、硬质合金、防腐合金、磁性合金和各种钴盐的重要原料,其金属性弱于 Fe 强于 Cu。某低位硫钴铜矿的成分为:CoS、CuFeS2、CaS、SiO2, 一种利用生物浸出并回收其中钴和铜的工艺流程如图:
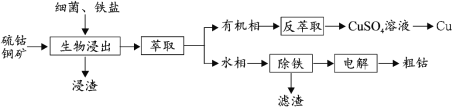
回答下列问题:
(1)Cu2+的生物浸出原理如下:
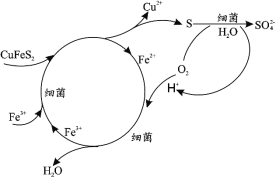
温度超过 50℃浸出率急剧下降,其原因是_____;其他金属离子的浸出原理与上图类似, 写出由 CoS 浸出 Co2+的离子方程式_____。
(2)浸出渣的主要成分为_____。
(3)萃取分离铜的原理如下:Cu2++2(HR)org![]() (CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(4)除铁步骤中加入 H2O2,调节溶液的 pH 至 4,将 Fe2+转化为 FeOOH 过滤除去,写出该转化的离子方程式为_____。检验 Fe2+是否完全被转化的试剂为_____。
(5)通过电解法制得的粗钴含有少量铜和铁,需要电解精炼,进行精炼时,精钴应处于_____极(填“阴”或“阳”),阳极泥的主要成分为_____。
【答案】温度过高细菌失活 ![]() CaSO4、SiO2 H2SO4
CaSO4、SiO2 H2SO4 ![]() 铁氰化钾 阴 铜
铁氰化钾 阴 铜
【解析】
(1)温度过高细菌失活,浸出率急剧下降,根据Cu2+的生物浸出推断Co2+的生物浸出;
(2)由生物浸出原理图可知S元素最终转化为SO42-,与Ca2+结合生成CaSO4沉淀,SiO2不参与反应,金属阳离子进入滤液;
(3)根据平衡移动原理可知,反萃取需加入酸,由流程图可知反萃取后得到CuSO4溶液。则应加入硫酸;
(4)H2O2和Fe2+反应生成FeOOH沉淀,根据电荷守恒和原子守恒配平方程;亚铁离子遇到铁氰化钾会生成深蓝色的沉淀,故检验亚铁离子可选用铁氰化钾溶液;
(5)电解精炼时粗钴为阳极,放电顺序为Fe>Co>Cu,精钴为阴极电解质为CoSO4,以此分析。
(1)温度过高细菌失活,浸出率急剧下降;根据Cu2+的生物浸出可知矿物再细菌和Fe3+作用下化合物中S元素转化为S单质,则Co2+的生物浸出离子方程式为:![]() ,故答案为 :温度过高细菌失活;
,故答案为 :温度过高细菌失活;![]() ;
;
(2)由生物浸出原理图可知S元素最终转化为SO42-,与Ca2+结合生成CaSO4,SiO2不参与反应,金属阳离子进入滤液,则浸出渣的主要成分为CaSO4、SiO2,故答案为:CaSO4、SiO2;
(3)根据平衡移动原理可知,反萃取需加入酸,由流程图可知反萃取后得到CuSO4溶液。则应加入硫酸,故答案为:H2SO4;
(4)H2O2和Fe2+反应生成FeOOH沉淀,离子方程式为![]() 。检验检验亚铁离子可用铁氰化钾溶液,若生成蓝色沉淀则存在亚铁离子,故答案为:
。检验检验亚铁离子可用铁氰化钾溶液,若生成蓝色沉淀则存在亚铁离子,故答案为:![]() ;铁氰化钾;
;铁氰化钾;
(5)电解精炼时粗钴为阳极,精钴做阴极。电解精炼时,Fe和Co溶解,Cu较不活泼,不能溶解,因此,阳极泥主要为铜,故答案为:阴;铜。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】复印机工作时易产生臭氧(O3),少量的臭氧有消毒空气之功效,但臭氧浓度过高时,对人的呼吸道、肺部有刺激。已知臭氧可发生如下反应:O3+2KI+H2O=2KOH+O2+I2,对该反应的下列说法不正确的是( )
A.KI发生的是氧化反应
B.O3是氧化剂,O3被还原生成的产物是KOH
C.氧化产物I2与还原产物O2的物质的量之比为1:1
D.H2O既不是氧化剂也不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2=H++HO2-,Ka=2.4×10-12)。下列说法错误的是( )
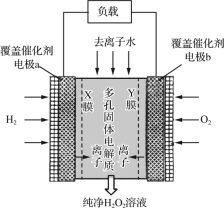
A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成1 mol H2O2电极上流过4 mol e-
D.b极上的电极反应为O2+H2O+2e-=HO2-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物 X(![]() )是合成重要医药中间体的原料。下列关于化合物X说法错误的是
)是合成重要医药中间体的原料。下列关于化合物X说法错误的是
A.分子中有 7 个碳原子共平面
B.能使酸性 KMnO4 溶液褪色
C.能与 HBr 发生加成反应
D.X 的同分异构体中不存在芳香族化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在太阳能可规模化分解水制氢方面取得新进展——率先提出并验证了一种全新的基于粉末纳米颗粒光催化剂太阳能分解水制氢的“氢农场”策略,其太阳能光催化全分解水制氢的效率创国际最高记录(示意图如图所示,M1、M2 为含铁元素的离子)。下列说法正确的是
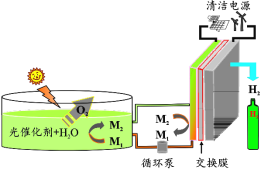
A.制 O2 装置中,太阳能转化为电能
B.制 H2 装置中,交换膜为阴离子交换膜
C.系统制得1mol H2的同时可制得 1mol O2
D.制H2时阳极可发生反应:[Fe(CN)6]4––e- = [Fe(CN)6]3–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用光伏电池提供电能处理废水中的污染物(有机酸阴离子用R-表示),并回收有机酸HR,装置如图所示。下列说法错误的是
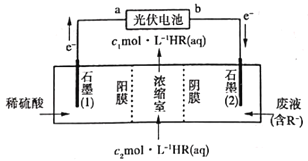
A.在光伏电池中a极为正极B.石墨(2)极附近溶液的pH降低
C.HR溶液:c2<c1D.若两极共收集3mol气体,则理论上转移4mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图有关图象,说法正确的是( )
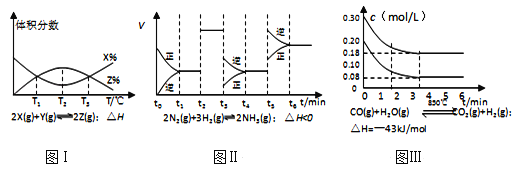
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C. 由图Ⅱ知,t3时采取降低反应体系温度的措施
D. 图Ⅲ表示在10L容器、850℃时的反应,由图知,到4min时,反应放出51.6kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一镁铝合金共51 g,把其加入到1 L 5 mol·L-1的盐酸中,恰好反应完。
(1)关于合金的下列说法正确的有________。
A.合金只能由两种或两种以上的金属组成
B.合金的硬度一般比其组成成分金属的硬度大
C.镁铝熔成合金的过程是一个化学过程
D.合金的熔点一般比其组成成分的熔点低
E.合金具备金属的特性
(2) 该合金中镁铝的质量分别为________g、________g。
(3) 反应中共收集到标况下的氢气的体积为___________L。
(4)向反应后的溶液中逐滴加入5 mol·L-1的NaOH溶液,若要使沉淀恰好达到最大值,需要加入NaOH________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫单质及其化合物在化工生成等领城应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法 1: 燃煤中加入生石灰,将SO2转化为 CaSO3,再氧化为CaSO4。
已知:a. CaO(s) +CO2 (g)=CaCO3 △H=-1 78.3kJmol-1
b. 2CaCO3(s) +2SO2(g) +O2(g)=2CaSO4(s) +2CO2(g) △H=-2762.2kJmol-1
c.2 CaSO3(s) + O2(g)=2CaSO4(s) △H =-2314.8 kJmol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:_____________。
②方法 2:用氨水将SO2转化为NH4HSO3 ,再氧化为(NH4)2SO4。实验测得NH4HSO3溶液中![]() = 1500 ,则溶液的pH 为_____________(已知:HSO3-的Ka1=1.5×l0-2, Ka2=l.0×l0-7)。
= 1500 ,则溶液的pH 为_____________(已知:HSO3-的Ka1=1.5×l0-2, Ka2=l.0×l0-7)。
(2)煤制得的化工原料气中含有羰基硫(O=C =S),该物质可转化为H2S,反应为COS(g)+ H2( g ) ![]() H2S(g) +CO(g) △H > 0。
H2S(g) +CO(g) △H > 0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是________________(填字母)。
a.COS的浓度保持不变 b. 化学平衡常数不再改变
c.混合气体的密度不再改变 d. 形成 2 mol H-S 键的同时形成 1 mol H-H 键
②T℃时 ,在恒容的密闭容器中 ,将定量的CO和H2S 混合加热并达到下列平衡:H2S(g) + CO(g)![]() COS(g) + H2(g),K=0.25,则该温度下反应 COS(g) +H2(g)=H2S(g) +CO(g)的平衡常数K __________。T1℃ 时,向容积为 10 L 的恒容密闭容器中充入 1 molCOS(g)和1 mol H2 (g),达到平衡时 COS 的转化率为_______。
COS(g) + H2(g),K=0.25,则该温度下反应 COS(g) +H2(g)=H2S(g) +CO(g)的平衡常数K __________。T1℃ 时,向容积为 10 L 的恒容密闭容器中充入 1 molCOS(g)和1 mol H2 (g),达到平衡时 COS 的转化率为_______。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式如图所示: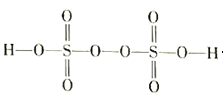
①在Ag+催化作用下,S2O82-能与 Mn2+ 在水溶液中发生反应生成SO42-和 MnO4-,1 molS2O82-能氧化的 Mn2+ 的物质的量为_____________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
(4)NaHS 可用作处理含 Hg2+的污水的沉淀剂,已知 25℃时,反应 Hg2+(aq) + HS-( aq) ![]() HgS(s) + H+(aq) 的平衡常数 K=l.75×l038 ,H2S的电离平衡常数Ka1=1.3×l0-7 , Ka2= 7.0×l 0-15,则Ksp(HgS) =__________________。
HgS(s) + H+(aq) 的平衡常数 K=l.75×l038 ,H2S的电离平衡常数Ka1=1.3×l0-7 , Ka2= 7.0×l 0-15,则Ksp(HgS) =__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com