
【题目】2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2=H++HO2-,Ka=2.4×10-12)。下列说法错误的是( )
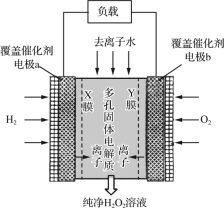
A.X膜为选择性阳离子交换膜
B.催化剂可促进反应中电子的转移
C.每生成1 mol H2O2电极上流过4 mol e-
D.b极上的电极反应为O2+H2O+2e-=HO2-+OH-
科目:高中化学 来源: 题型:
【题目】如图X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。接通电路后,发现d附近显红色。

(1)①电源上b为___极
②Z槽中e为___极。
③连接Y、Z槽线路中,电子流动的方向是d___e(用“→”或“←”填空)。
(2)①写出Y槽中总反应的化学方程式:____。
②写出Z槽中e极上反应的电极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的分离与提纯是化学实验的重点。根据下列实验目的,分别选择相应的实验装置,将其实验编号填在对应的横线上。
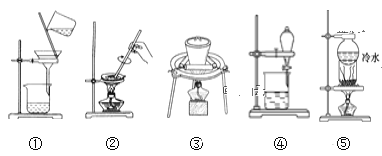
(1)从溴水中提取溴__。
(2)除去氧化钙中的碳酸钙__。
(3)分离食盐和碘的混合物__。
(4)除去硫酸钡固体中少量的硝酸钾__。
(5)从氯化钠溶液中得到氯化钠晶体__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的化学式:
胆矾_____________________ 铁红_____________________
苏打_____________________ 明矾__________________
(2)把SO2气体通入品红溶液中,现象为_____,将该溶液加热后,现象为________。把Cl2通入紫色石蕊试液中,现象为_____,将SO2通入紫色石蕊试液中,现象为______。
(3)工业上将氯气通入冷的消石灰[Ca(OH)2]中即制得漂白粉.写出该反应的化学方程式_____,在该反应中,氧化产物是_____(用化学式表示)。
(4)碳酸氢钠可用作治疗胃酸(主要含盐酸)过多的药剂,写出该反应的离子方程式________
(5)常用来作为潜水艇和呼吸面具中氧气来源的是_____________,它的颜色为______;
(6)在试管里放入一块铜片,注入一定体积的浓硫酸 ,给试管加热,使之反应。若铜片还有剩余,硫酸_______消耗完毕(填“已”或“没有”),其理由是_____________;继续向上述溶液中加入下列________物质,铜片会继续溶解。
A.KNO3 B.FeCl3 C.盐酸 D.氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一小块金属钠,用滤纸吸干表面的煤油,用小刀切开后,可看到断面呈____色,具有_____光泽,但断面很快变___________,主要是由于生成一薄层_______。若把钠放在石棉网上加热,可观察到的现象是_______________ ,反应的化学方程式为_______其中还原剂为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.  与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B. 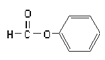 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。钠及其氧化物的物质的量 均为0.1 mol,水的质量为100 g。下列说法正确的是

A.甲、乙、丙都属于氧化还原反应
B.甲反应的离子方程式为Na+2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
C.丙充分反应,能产生0.05 mol O2,转移电子0.1 mol
D.甲、乙、丙充分反应后所得溶液的质量分数分别为w1、w2、w3,则2w1=w2=w3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)是生产耐热合金、硬质合金、防腐合金、磁性合金和各种钴盐的重要原料,其金属性弱于 Fe 强于 Cu。某低位硫钴铜矿的成分为:CoS、CuFeS2、CaS、SiO2, 一种利用生物浸出并回收其中钴和铜的工艺流程如图:
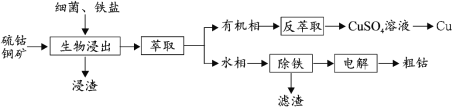
回答下列问题:
(1)Cu2+的生物浸出原理如下:
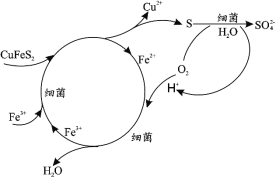
温度超过 50℃浸出率急剧下降,其原因是_____;其他金属离子的浸出原理与上图类似, 写出由 CoS 浸出 Co2+的离子方程式_____。
(2)浸出渣的主要成分为_____。
(3)萃取分离铜的原理如下:Cu2++2(HR)org![]() (CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(4)除铁步骤中加入 H2O2,调节溶液的 pH 至 4,将 Fe2+转化为 FeOOH 过滤除去,写出该转化的离子方程式为_____。检验 Fe2+是否完全被转化的试剂为_____。
(5)通过电解法制得的粗钴含有少量铜和铁,需要电解精炼,进行精炼时,精钴应处于_____极(填“阴”或“阳”),阳极泥的主要成分为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及钙镁的化合物等。某实验小组利用其提取Al(OH)3
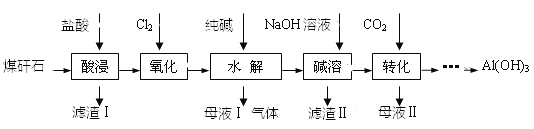
(1)“酸浸”过程中发生的主要反应的离子方程式为_______________。
(2)“氧化”的目的是_____________。检验Fe3+的方法是______________。
(3)滤渣I的主要成份________。溶于酸的反应方程式______________。
(4)②“转化”时主要反应的离子方程式为_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com