
����Ŀ��ij��ú��ʯ��Ԥ��������Ҫ��SiO2��61%����Al2O3��30%����������Fe2O3��FeO����þ�Ļ�����ȡ�ijʵ��С����������ȡAl(OH)3
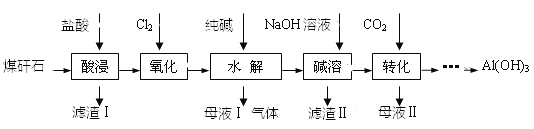
��1��������������з�������Ҫ��Ӧ�����ӷ���ʽΪ_______________��
��2������������Ŀ����_____________������Fe3+�ķ�����______________��
��3������I����Ҫ�ɷ�________��������ķ�Ӧ����ʽ______________��
��4������ת����ʱ��Ҫ��Ӧ�����ӷ���ʽΪ_________________________________��
���𰸡�Al2O3��6H+=2Al3+��3H2O ��Fe2+������Fe3+����������ˮ���ȥ��Ԫ�� ȡ��������Һ���Թ��У��μ�KSCN��Һ������Һ����Ѫ��ɫ����֤����Fe3+ SiO2 SiO2+4HF=SiF4��+2H2O AlO2-��CO2��2H2O=Al(OH)3����HCO3-����2AlO2-��CO2��3H2O=2Al(OH)3����CO32-��
��������
ú��ʯ����ϡ���ᷢ���ķ�Ӧ��![]() ��
��![]() ��
��![]() ��Ȼ����ˣ��õ�������IΪSiO2������Һ��ͨ�������������ķ�ӦΪ
��Ȼ����ˣ��õ�������IΪSiO2������Һ��ͨ�������������ķ�ӦΪ![]() ������Һ�м���̼���ƣ������ķ�ӦΪ
������Һ�м���̼���ƣ������ķ�ӦΪ![]() ��
��![]() ��
��![]() ��
��![]() �����˵õ�����Һ�к���NaCl���������м������NaOH��Һ��Al��OH��3�ܽ⣬����������ܽ⣬���˺�õ�������IIΪCaCO3��Mg��OH��2��Fe��OH��3����Һ�к���NaAlO2������Һ��ͨ�������̼�������ķ�ӦΪ
�����˵õ�����Һ�к���NaCl���������м������NaOH��Һ��Al��OH��3�ܽ⣬����������ܽ⣬���˺�õ�������IIΪCaCO3��Mg��OH��2��Fe��OH��3����Һ�к���NaAlO2������Һ��ͨ�������̼�������ķ�ӦΪ![]() ����
����![]() ����Ȼ����˵õ�Al��OH��3����ҺII�к���NaHCO3��̼���ƣ��ݴ˷������
����Ȼ����˵õ�Al��OH��3����ҺII�к���NaHCO3��̼���ƣ��ݴ˷������
��1����������н��������ﶼ��ϡ���ᷴӦ�����Ȼ����Ҫ���ӷ�Ӧ����ʽΪ![]() ��
��
�ʴ�Ϊ��![]() ��
��
��2����������ˮ�����ɳ�������Ҫ��pH��С����Fe2+������Fe3+����������ˮ���ȥ��Ԫ�أ���������KSCN��Һ���飬����鷽���ǣ�ȡ����ĸҺ�μ�KSCN��Һ����Ѫ��ɫ����Fe3+��ˮ����ȫ��
�ʴ�Ϊ����Fe2+������Fe3+����������ˮ���ȥ��Ԫ�أ�ȡ��������Һ���Թ��У��μ�KSCN��Һ������Һ����Ѫ��ɫ����֤����Fe3+��
��3��ͨ�����Ϸ���֪������I�ijɷ�ΪSiO2��SiO2ֻ�ܺ�HF������Ӧ![]() �ʴ�Ϊ��SiO2��
�ʴ�Ϊ��SiO2��![]() ��
��
��4��ͨ�����Ϸ���֪��ת��ʱ���������ӷ�Ӧ����ʽΪ![]() ����
����![]() �����ʴ�Ϊ��
�����ʴ�Ϊ��![]() ����
����![]() ����
����


 ��������ѧ����ϵ�д�
��������ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019��11�¡�Science����־����������������Ŷӷ�������ȡH2O2����ɫ������ԭ����ͼ��ʾ(��֪��H2O2=H����HO2����Ka��2.4��10��12)������˵���������(����)
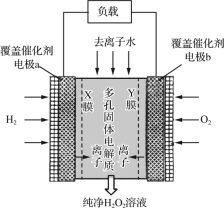
A.XĤΪѡ���������ӽ���Ĥ
B.�����ɴٽ���Ӧ�е��ӵ�ת��
C.ÿ����1 mol H2O2�缫������4 mol e��
D.b���ϵĵ缫��ӦΪO2��H2O��2e��=HO2����OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�й�ͼ��˵����ȷ���ǣ� ��
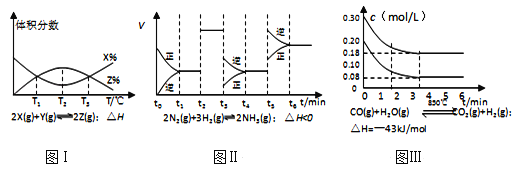
A. ��ͼ��֪����Ӧ��T1��T3���ﵽƽ�⣬�Ҹ÷�Ӧ�ġ�H��0
B. ��ͼ��֪����Ӧ��t6ʱ�̣�NH3����������
C. ��ͼ��֪��t3ʱ��ȡ���ͷ�Ӧ��ϵ�¶ȵĴ�ʩ
D. ͼ���ʾ��10L������850��ʱ�ķ�Ӧ����ͼ֪����4minʱ����Ӧ�ų�51.6kJ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һþ���Ͻ�51 g��������뵽1 L 5 mol��L��1�������У�ǡ�÷�Ӧ�ꡣ
(1)���ںϽ������˵����ȷ����________��
A���Ͻ�ֻ�������ֻ��������ϵĽ������
B���Ͻ��Ӳ��һ�������ɳɷֽ�����Ӳ�ȴ�
C��þ���۳ɺϽ�Ĺ�����һ����ѧ����
D���Ͻ���۵�һ�������ɳɷֵ��۵��
E���Ͻ�߱�����������
(2) �úϽ���þ���������ֱ�Ϊ________g��________g��
(3) ��Ӧ�й��ռ�������µ����������Ϊ___________L��
(4)��Ӧ�����Һ����μ���5 mol��L��1��NaOH��Һ����Ҫʹ����ǡ�ôﵽ���ֵ����Ҫ����NaOH________L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���FΪij�����ǰ���壬��ϳ�·����ͼ��ʾ�����ַ�Ӧ��������ȥ����
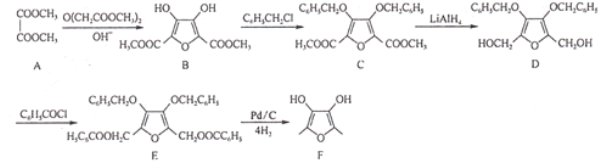
�ش��������⣺
��1��A�Ļ�ѧ����Ϊ________��
��2��B�г��ǻ��⣬�������������ŵ�����Ϊ________��ȷ���Ƿ������Щ�����ţ����õļ���ֶ���________������ĸ����
a.�˴Ź�������b.����
c.�������d.Xһ�������䷨
��3����B����C�ķ�Ӧ����Ϊ________�����øò����Ŀ����________��
��4��д����D����E�Ļ�ѧ����ʽ��________��
��5��д��һ��ͬʱ���������ĸ�������B��ͬ���칹��Ľṹ��ʽ��________��
a.���ڷ����廯��������ڡ���O��O�����ṹ��
b.lmol�������������5molNaOH,����������NaHCO3��Һ��Ӧ��������22.4LCO2(��״������
c.�˴Ź���������ʾ��4�ֲ�ͬ��ѧ�������⣮
��6�����������ϳ�·�ߣ�д����![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() �ĺϳ�·�ߣ�________�������Լ���ѡ����
�ĺϳ�·�ߣ�________�������Լ���ѡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ͬѧ����ϡ������п��ȡ������ʵ�飬��ش��������⣺
��1����ͬѧ���ּ�����������ͭ��Һ�ɼӿ��������������ʡ�Ϊ�˽�һ���о�����ͭ�����������������ʵ�Ӱ�죬���������һϵ��ʵ�顣�����������Ļ����Һ�ֱ���뵽6��ʢ�й���Zn���ķ�Ӧƿ�У��ռ����������壬��¼�����ͬ�������������ʱ�䡣
������������ʵ�� �����Һ���������� | A | B | C | D | E | F |
4 mol��L��1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
����CuSO4��Һ/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
������ɴ�ʵ����ƣ����У�V1��___��V6��___��V9��___��
�ڷ�Ӧһ��ʱ���ʵ��A�еĽ�����___ɫ��ʵ��E�еĽ�����___ɫ��
�۸�ͬѧ���ó��Ľ���Ϊ������������CuSO4��Һʱ���������������ʻ�����ߡ����������CuSO4��Һ����һ����ʱ���������������ʷ������½���������������������½�����Ҫԭ��___________________________��
��2����ͬѧΪ��̽��п��ϡ���ᷴӦ�����е����ʼ������ı仯����������ʵ�飬����Ӱ�췴Ӧ���ʵ����ء�
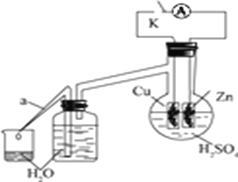
ʵ��ʱ���ӶϿ�K��ʼ��ÿ���1���ӣ�����Ͽ���պ�K������������ÿ1�����ڴ�a��������ˮ�������õ���ˮ�������±���ʾ��
1����ˮ�������Ͽ�K�� | 34 | 59 | 86 | 117 | �� | 102 |
1����ˮ�������պ�K�� | 58 | 81 | 112 | 139 | �� | 78 |
������Ӧ�����е�ˮ��������ش�
�� ��ˮ����58��34��81��59��˵���ڷ�Ӧ���ڣ��պ�Kʱ�ȶϿ�Kʱ�ķ�Ӧ���ʿ죬��Ҫԭ����__________________________________________________________��
�� ��ˮ����102��78��˵���ڷ�Ӧ���ڣ��Ͽ�Kʱ�ķ�Ӧ���ʿ��ڱպ�Kʱ�ķ�Ӧ���ʣ���Ҫԭ����____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ���е����ߣ�������Ϊ���������������������Ϊ�������ʵ����������д������
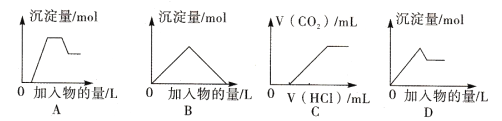
A. ͼA��ʾ��H+��Mg2+��Al3+��NH4+����Һ�еμ�NaOH��Һ�����������Ĺ�ϵ����
B. ͼB��ʾ�����ʯ��ˮ��ͨ�������ֱ̼�����������������Ĺ�ϵ����
C. ͼC��ʾ��NaOH��Na2CO3�Ļ��Һ�еμ��������CO2����Ĺ�ϵ����
D. ͼD��ʾ��������Һ�еμ�Ba��OH��2��Һ�����������Ĺ�ϵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʼ��仯�����ڻ������ɵ����Ӧ�ù㷺��
(1)��ҵβ���е�SO2һֱ�ǻ�����Ⱦ����Ҫԭ��֮һ����ҵ�ϳ��������·�������β���еĺ�����:
�ٷ��� 1: ȼú�м�����ʯ�ң���SO2ת��Ϊ CaSO3,������ΪCaSO4��
��֪��a. CaO(s) +CO2 (g)=CaCO3 ��H=-1 78.3kJmol-1
b. 2CaCO3(s) +2SO2(g) +O2(g)=2CaSO4(s) +2CO2(g) ��H=-2762.2kJmol-1
c.2 CaSO3(s) + O2(g)=2CaSO4(s) ��H =-2314.8 kJmol-1
д��CaO(s)��SO2(g)��Ӧ����CaSO3(s)���Ȼ�ѧ����ʽ��_____________��
�ڷ��� 2:�ð�ˮ��SO2ת��ΪNH4HSO3 ,������Ϊ(NH4)2SO4��ʵ����NH4HSO3��Һ��![]() = 1500 ,����Һ��pH Ϊ_____________(��֪��HSO3-��Ka1=1.5��l0-2, Ka2=l.0��l0-7)��
= 1500 ,����Һ��pH Ϊ_____________(��֪��HSO3-��Ka1=1.5��l0-2, Ka2=l.0��l0-7)��
(2)ú�ƵõĻ���ԭ�����к����ʻ���(O=C =S),�����ʿ�ת��ΪH2S,��ӦΪCOS(g)+ H2( g ) ![]() H2S(g) +CO(g) ��H > 0��
H2S(g) +CO(g) ��H > 0��
�ٺ��º��������£��ܱ������з���������Ӧ��������ʵ����˵����Ӧ�ﵽƽ��״̬����________________(����ĸ)��
a.COS��Ũ�ȱ��ֲ��� b. ��ѧƽ�ⳣ�����ٸı�
c.���������ܶȲ��ٸı� d. �γ� 2 mol H-S ����ͬʱ�γ� 1 mol H-H ��
��T��ʱ ���ں��ݵ��ܱ������� ����������CO��H2S ��ϼ��Ȳ��ﵽ����ƽ�⣺H2S(g) + CO(g)![]() COS(g) + H2(g),K=0.25,����¶��·�Ӧ COS(g) +H2(g)��H2S(g) +CO(g)��ƽ�ⳣ��K __________��T1�� ʱ�����ݻ�Ϊ 10 L �ĺ����ܱ������г��� 1 molCOS(g)��1 mol H2 (g),�ﵽƽ��ʱ COS ��ת����Ϊ_______��
COS(g) + H2(g),K=0.25,����¶��·�Ӧ COS(g) +H2(g)��H2S(g) +CO(g)��ƽ�ⳣ��K __________��T1�� ʱ�����ݻ�Ϊ 10 L �ĺ����ܱ������г��� 1 molCOS(g)��1 mol H2 (g),�ﵽƽ��ʱ COS ��ת����Ϊ_______��
(3)��������(H2S2O8)��һ��ǿ�������ᣬ��ṹʽ��ͼ��ʾ��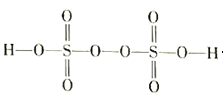
����Ag+�������£�S2O82-���� Mn2+ ��ˮ��Һ�з�����Ӧ����SO42-�� MnO4-��1 molS2O82-�������� Mn2+ �����ʵ���Ϊ_____________mol��
�ڹ�ҵ�Ͽ��ö��Ե缫������������炙����Һ�Ʊ���������李��������ĵ缫��ӦʽΪ______________________��
(4)NaHS ������������ Hg2+����ˮ�ij���������֪ 25��ʱ����Ӧ Hg2+(aq) + HS-( aq) ![]() HgS(s) + H+(aq) ��ƽ�ⳣ�� K=l.75��l038 ,H2S�ĵ���ƽ�ⳣ��Ka1=1.3��l0-7 , Ka2= 7.0��l 0-15,��Ksp(HgS) =__________________��
HgS(s) + H+(aq) ��ƽ�ⳣ�� K=l.75��l038 ,H2S�ĵ���ƽ�ⳣ��Ka1=1.3��l0-7 , Ka2= 7.0��l 0-15,��Ksp(HgS) =__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����������װ��̽�������백���ķ�Ӧ������A��B�ֱ�Ϊ�����Ͱ����ķ���װ�ã�CΪ��������������백����Ӧ��װ�ã�

��1����Cl2��������������NH3��������������������ʵ��װ���У��������ӵĺ���˳��Ϊ��A��________________��B��ΪʹNH3��Cl2����ֻ�ϣ�Cl2Ӧ��Cװ�õ�__�ڽ��루�x����y������
��2������װ��A��ʹ�÷�Һ©����Բ����ƿ�еμ�Ũ����IJ�����__________________��
��3��װ��A�з�����Ӧ�����ӷ���ʽΪ_______________________________��
��4��װ��B��Բ����ƿ�ڵ��Լ�Ϊ______________�������ƣ���
��5��װ��D��������____________________________��
��6����Ӧ��ʼ��װ��C�ڳ���Ũ��İ��̲��������ڱ����ᣬ��һ�������ǿ����е���Ҫ�ɷ�֮һ���÷�Ӧ�Ļ�ѧ����ʽΪ________________________________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com