
【题目】某组甲乙同学进行稀硫酸与锌制取氢气的实验,请回答下列问题:
(1)甲同学发现加入少量硫酸铜溶液可加快氢气的生成速率。为了进一步研究硫酸铜的量对氢气生成速率的影响,设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4 mol·L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1=___,V6=___,V9=___;
②反应一段时间后,实验A中的金属呈___色,实验E中的金属呈___色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高。但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因___________________________。
(2)乙同学为了探究锌与稀硫酸反应过程中的速率及能量的变化,进行以下实验,分析影响反应速率的因素。
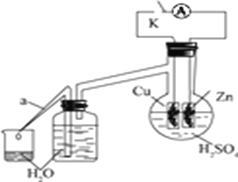
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1分钟内从a管流出的水滴数,得到的水滴数如下表所示:
1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
① 由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率快,主要原因是__________________________________________________________。
② 由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是____________________________________。
【答案】30 10 17.5 灰黑 暗红 当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,减少了Zn与溶液的接触面积 形成原电池反应速度快 断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),c(H+)的影响是主要因素
【解析】
(1)①为保证实验有对比性,只能改变一个变量分析,CuSO4溶液体积逐渐增多,故H2SO4的量应相等均为30mL,水的量减小,但每组实验中CuSO4与水的体积之和应相等;
②实验A中锌粒与稀硫酸反应,因锌粒不纯,表面会有杂质的颜色;而实验E中生成的单质Cu会沉积在Zn的表面;
③锌粒与硫酸铜反应生成的铜会附在锌粒表面;
(2)①原电池可加快化学反应速率;
②根据氢离子浓度大小与速率的关系分析;
(1)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同,故A组中硫酸为30mL,那么其它组硫酸量也都为30mL;而硫酸铜溶液和水的总量应相同,F组中硫酸铜20mL,水为0,那么总量为20mL,所以V6=10mL,V9=17.5mL,V1=30mL,
故答案为:30;10;17.5;
②不纯的锌粒中含有Pb、Bi、Sn等杂质,实验A中锌粒与稀硫酸反应后, 这些不活泼的金属杂质游离出来,以颗粒状沉积在锌粒表面呈灰黑色;而实验E中过量的锌粒会与硫酸铜反应生成铜,形成原电池,加快化学反应速率,因此该实验中暗红色的铜会附着在锌粒表面,故答案为:灰黑;暗红;
③因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,减少了Zn与溶液的接触面积;
(2)①因在反应初期,形成了原电池,所有闭合K时比断开K时的反应速率快,故答案为:形成原电池反应速度快;
②由于反应前期形成原电池反应速率快,氢离子消耗的多,则在后期,闭合K时溶液中氢离子浓度小,氢离子浓度越小反应速率越小,断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),所以在反应后期,断开K时的反应速率快于闭合K时的反应速率;
故答案为:断开K时,溶液中的c(H+)大于闭合K时溶液中的c(H+),c(H+)的影响是主要因素;


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.  与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B. 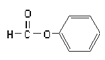 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种强电解质溶液分别含有下列阴、阳离子中的各一种且不重复:NH![]() 、Ba2+、H+、Na+、SO42-、CO32-、NO3-、OH﹣已知:①向A或D中滴入C,均有沉淀生成:
、Ba2+、H+、Na+、SO42-、CO32-、NO3-、OH﹣已知:①向A或D中滴入C,均有沉淀生成:
②向A和B中分别滴加D(可加热)均有气体生成(又已知:D和B反应生成的气体能被A吸收),且这两种气体在水中能反应生成D。 试回答下列问题:
(1)写出A、B、C、D四种溶液中溶质的化学式:
A______________,B______________,C______________,D______________。
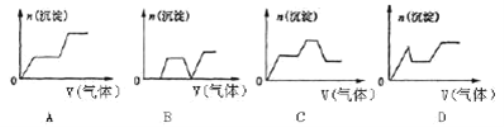
(2)将A与D反应生成的气体缓慢通入含KOH、Ca(OH)2、NaAlO2的混合溶液中,生成沉淀的物质的量n与通入气体的体积V的关系可表示______________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠硫电池作为一种新型储能电池,其应用逐渐得到重视和发展。
(1)钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2SX)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
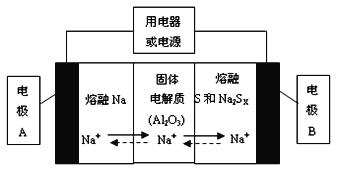
①根据上右表数据,请你判断该电池工作的适宜应控制在_________(填字母)范围内。
物质 | Na | S | Al2O3 |
熔点/℃ | 97.8 | 115 | 2050 |
沸点/℃ | 892 | 444.6 | 2980 |
a.100℃以下 b.100~300℃ c.300~350℃ d.350~2050℃
②放电时,电极A为_________极,电极B发生_________反应(填“氧化或还原”)
③充电时,总反应为Na2SX=2Na+xS(3<x<5),则阳极的电极反应式为:________________。
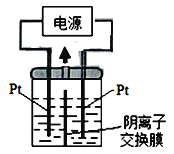
(2)若把钠硫电池作为电源,电解槽内装有KI及淀粉溶液如图所示,槽内的中间用阴离子交换膜隔开。通电一段时间后,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。则右侧发生的电极方程式:___________;试分析左侧溶液蓝色逐渐变浅的可能原因是:___________。
(3)若把钠硫电池作为电源,按如图所示装置进行实验电解乙池和丙池:
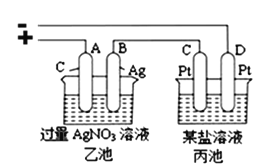
当钠硫电池中消耗0.05xmol的S时,理论上乙池中B极的质量增加__________g;此时丙装置中___________(填“C”或“D”)电极析出7.20g金属,则丙装置中的某盐溶液可能是_______(填序号)。
a.MgSO4溶液 b.CuSO4溶液 c.NaCl溶液 d.AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地煤矸石经预处理后主要含SiO2(61%)、Al2O3(30%)和少量的Fe2O3、FeO及钙镁的化合物等。某实验小组利用其提取Al(OH)3
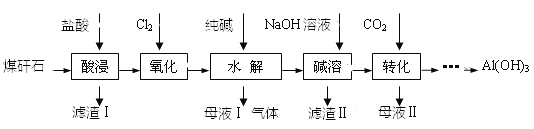
(1)“酸浸”过程中发生的主要反应的离子方程式为_______________。
(2)“氧化”的目的是_____________。检验Fe3+的方法是______________。
(3)滤渣I的主要成份________。溶于酸的反应方程式______________。
(4)②“转化”时主要反应的离子方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
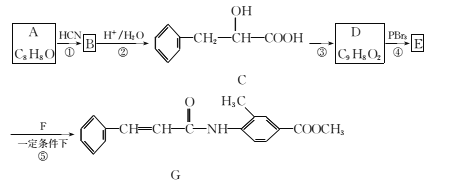
【题目】某新型药物G合成路线如图所示:
已知:Ⅰ.RCHO![]()
![]() (R为烃基);
(R为烃基);
Ⅱ.RCOOH![]()
![]() ;
;
Ⅲ. ![]() +RNH2
+RNH2![]()
![]()
请回答下列问题:
(1)A的名称为 ___,合成路线图中反应③所加的试剂和反应条件分别是______。
(2)下列有关说法正确的是 __(填字母代号)。
A. 反应①的反应类型为取代反应
B. C可以发生的反应类型有取代、加成、消去、加聚
C. D中所有碳原子可能在同一平面上
D. 一定条件下1 mol G可以和2 mol NaOH或者9 mol H2反应
(3)F的结构简式为____。
(4)C在一定条件下可以发生聚合反应生成高分子化合物,写出该反应的化学方程式 ______。
(5)D有多种同分异构体,同时满足下列条件的同分异构体有 ___种。
①属于芳香族化合物,且分子中含有的环只有苯环
②能发生银镜反应和水解反应
(6)参照G的上述合成路线,设计一条由乙醛和H2NCH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧瓶中各盛有100mL 5mol·L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为( )
A.2.7gB.3.6gC.5.4gD.6.75g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2L氧气所含的原子数为NA
B.1.8gNH4+离子中含有的电子数为NA
C.常温常压下,48gO3含有的氧原子数为NA
D.5.6g金属铁与足量氯气充分反应时失去的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:
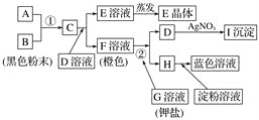
(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com