
【题目】有机化合物 X(![]() )是合成重要医药中间体的原料。下列关于化合物X说法错误的是
)是合成重要医药中间体的原料。下列关于化合物X说法错误的是
A.分子中有 7 个碳原子共平面
B.能使酸性 KMnO4 溶液褪色
C.能与 HBr 发生加成反应
D.X 的同分异构体中不存在芳香族化合物
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列关系正确的是( )
A. 沸点:戊烷>2,2-二甲基戊烷>2,3-二甲基丁烷>丙烷
B. 密度:CCl4>CHCl3>H2O>苯
C. 含氢质量分数:甲烷>乙烷>乙烯>乙炔>苯
D. 等质量的物质燃烧耗O2量:苯>乙烷>乙烯>甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的化学式:
胆矾_____________________ 铁红_____________________
苏打_____________________ 明矾__________________
(2)把SO2气体通入品红溶液中,现象为_____,将该溶液加热后,现象为________。把Cl2通入紫色石蕊试液中,现象为_____,将SO2通入紫色石蕊试液中,现象为______。
(3)工业上将氯气通入冷的消石灰[Ca(OH)2]中即制得漂白粉.写出该反应的化学方程式_____,在该反应中,氧化产物是_____(用化学式表示)。
(4)碳酸氢钠可用作治疗胃酸(主要含盐酸)过多的药剂,写出该反应的离子方程式________
(5)常用来作为潜水艇和呼吸面具中氧气来源的是_____________,它的颜色为______;
(6)在试管里放入一块铜片,注入一定体积的浓硫酸 ,给试管加热,使之反应。若铜片还有剩余,硫酸_______消耗完毕(填“已”或“没有”),其理由是_____________;继续向上述溶液中加入下列________物质,铜片会继续溶解。
A.KNO3 B.FeCl3 C.盐酸 D.氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.  与
与![]() 含有相同的官能团,互为同系物
含有相同的官能团,互为同系物
B. 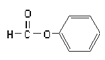 属于醛类,官能团为-CHO
属于醛类,官能团为-CHO
C. ![]() 的名称为:2-乙基-1-丁烯
的名称为:2-乙基-1-丁烯
D. ![]() 的名称为:2-甲基-1,3-二丁烯
的名称为:2-甲基-1,3-二丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应。钠及其氧化物的物质的量 均为0.1 mol,水的质量为100 g。下列说法正确的是

A.甲、乙、丙都属于氧化还原反应
B.甲反应的离子方程式为Na+2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
C.丙充分反应,能产生0.05 mol O2,转移电子0.1 mol
D.甲、乙、丙充分反应后所得溶液的质量分数分别为w1、w2、w3,则2w1=w2=w3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组查阅资料知:苯和液溴在有铁存在的条件下可反应生成溴苯和溴化氢,此反应为放热反应,他们用图装置制取溴苯,先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(此时A下端活塞关闭)中。
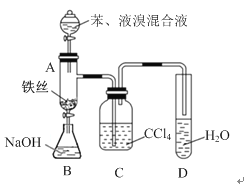
(1)写出A中反应的化学方程式__________________;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_________,写出有关的离子方程式____________________;生成的有机物物位于溶液______层(填“上”或“下”)。
(3)C中盛放CCl4的作用是______________________;
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生________,则能证明;另一种验证的方法是向试管D滴加_____________,溶液变红色则能证明。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴(Co)是生产耐热合金、硬质合金、防腐合金、磁性合金和各种钴盐的重要原料,其金属性弱于 Fe 强于 Cu。某低位硫钴铜矿的成分为:CoS、CuFeS2、CaS、SiO2, 一种利用生物浸出并回收其中钴和铜的工艺流程如图:
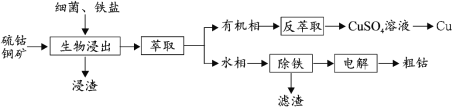
回答下列问题:
(1)Cu2+的生物浸出原理如下:
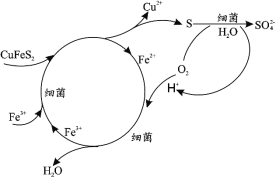
温度超过 50℃浸出率急剧下降,其原因是_____;其他金属离子的浸出原理与上图类似, 写出由 CoS 浸出 Co2+的离子方程式_____。
(2)浸出渣的主要成分为_____。
(3)萃取分离铜的原理如下:Cu2++2(HR)org![]() (CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(CuR2)org+2H+。根据流程,反萃取加入的试剂应该为_____(写化学式)。
(4)除铁步骤中加入 H2O2,调节溶液的 pH 至 4,将 Fe2+转化为 FeOOH 过滤除去,写出该转化的离子方程式为_____。检验 Fe2+是否完全被转化的试剂为_____。
(5)通过电解法制得的粗钴含有少量铜和铁,需要电解精炼,进行精炼时,精钴应处于_____极(填“阴”或“阳”),阳极泥的主要成分为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
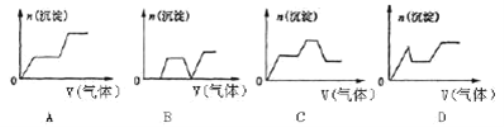
【题目】A、B、C、D四种强电解质溶液分别含有下列阴、阳离子中的各一种且不重复:NH![]() 、Ba2+、H+、Na+、SO42-、CO32-、NO3-、OH﹣已知:①向A或D中滴入C,均有沉淀生成:
、Ba2+、H+、Na+、SO42-、CO32-、NO3-、OH﹣已知:①向A或D中滴入C,均有沉淀生成:
②向A和B中分别滴加D(可加热)均有气体生成(又已知:D和B反应生成的气体能被A吸收),且这两种气体在水中能反应生成D。 试回答下列问题:
(1)写出A、B、C、D四种溶液中溶质的化学式:
A______________,B______________,C______________,D______________。
(2)将A与D反应生成的气体缓慢通入含KOH、Ca(OH)2、NaAlO2的混合溶液中,生成沉淀的物质的量n与通入气体的体积V的关系可表示______________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两烧瓶中各盛有100mL 5mol·L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为( )
A.2.7gB.3.6gC.5.4gD.6.75g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com