
科目: 来源: 题型:
【题目】17.4g MnO2与240 mL 10 mol/L(密度为1.10g/mL)的盐酸(足量)混合加热(不考虑盐酸挥发),使其充分反应后,再向溶液中加入足量的AgNO3溶液。(已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
试求:(1)10 mol/L的盐酸的质量分数____________
(2)产生的气体在标准状况下的体积______________;
(3)产生沉淀的质量_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】把1 L 0.1 mol/L的醋酸溶液用蒸馏水稀释到10 L,下列叙述正确的是( )
A. c(CH3COOH)变为原来的1/10
B. c(H+)变为原来的![]()
C. c(CH3COO-)/c(CH3COOH)的比值增大
D. 溶液的导电性增强
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在容积固定的密闭容器中发生反应:C(s)+H2O(g) ![]() CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
CO(g)+H2(g),下列说法中,不能说明反应达到化学平衡状态的是
A. 容器内CO的物质的量分数保持不变B. 容器内体系的压强保持不变
C. 容器内气体的密度保持不变D. 单位时间内消耗1molH2O(g),同时生成1molCO(g)
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组同学取锌粒与浓H2SO4充分反应制取SO2气体,待锌粒全部溶解后,同学们准备用收集到的气体(X)准备做实验,但是老师说收集到的气体(X)可能含有杂质。
(1)该化学兴趣小组制得的气体(X)中混有的主要杂质气体可能是________(填化学式),写出此过程所发生的2个化学反应方程式:_______________________; ______________________。
(2)一定质量的Zn与87.5mL 16.0mol/L浓硫酸充分反应,反应后称量剩余锌发现质量减少了78g,产生SO2体积(标准状况下)= _____________L。
(3)为证实相关分析,该小组的同学设计了如下图所示的实验装置,对此气体(X)取样进行认真研究(遇有气体吸收过程,可视为全吸收)。
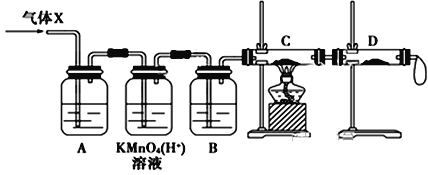
①酸性KMnO4溶液的作用是__________________;B中添加的试剂是_____________。
②装置C中所装药品为________________,可证实气体X中混有较多量某杂质气体的实验现象是_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):
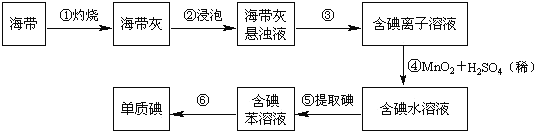
请填写下列空白:(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)___________.
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是_________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是_________.
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是________________________.
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法是:____________.
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.

(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的是(填序号)___________;
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,与实验Ⅲ相比,实验Ⅳ的优点_____________;
(3)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是_______;
(4)另有两瓶溶液,已知分别是K2CO3和NaHCO3,请你写出两种不同的鉴别方法.
①_____________________________,②______________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学采用如图装置进行实验,证明了铜与稀硝酸反应生成了NO。实验时,先向注射器内加入一定量的稀硝酸,排净注射器内的空气,迅速将带有铜丝的橡皮帽盖上,一段时间后,注射器内有无色气体产生。

(1)铜与稀硝酸反应的化学方程式为_________________。
(2)NO是大气污染物之一。目前有一种治理方法是在400℃左右、有催化剂存在的情况下,用氨气把NO还原为氮气和水。该反应的化学方程式为4NH3+6NO![]() 5N2+6H2O,每有5 mol N2生成,氧化产物与还原产物的物质的量之比为__________。
5N2+6H2O,每有5 mol N2生成,氧化产物与还原产物的物质的量之比为__________。
(3)若将上述稀硝酸换成浓硝酸,其生成的气体通入水中,该气体与水反应的化学方程式为______________________________________________。
(4)①写出实验室由NH4Cl和Ca(OH)2加热制取氨气的化学方程式__________。
②进行喷泉实验,若在水中加入酚酞,得到红色喷泉。该实验体现了氨气的两个重要性质分别是________________________、___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知2P4+9KOH+3H2O═3K3PO4+5PH3反应中氧化剂是______; 氧化剂与还原剂物质的量之比是_________;氧化产物是____________。
(2)请用双线桥法标出下列反应电子转移的方向和数目10Al+6NaNO3 +4NaOH═10NaAlO2 +3N2↑+2H2O______________________
(3)Mn2+、Bi3+、BiO3﹣、MnO4﹣、H+、H2O组成的一个氧化还原系统中,发生BiO3﹣→Bi3+的反应过程,据此回答下列问题 ①该氧化还原反应中,被还原的元素是____________。
②请将氧化剂、还原剂的化学式及配平后的方程式填入下列相应的位置中,并用单线桥法标出电子转移的方向和数目_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有 100 mL 0.5 mol/LCa(CIO)2溶液,向其中缓慢通入CO2(如图所示)。下列说法错误的是
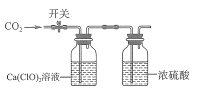
已知:①![]()
②溶液中粒子浓度可用以下公式计算:![]()
![]()
A.0.01 mol CO2通入溶液时发生反应的化学方程式为![]()
B.通入0.1 mol CO2后,用HNO3维持体系 pH=6,此时溶液中粒子浓度大小关系为c(HCO3-)>c(HCIO)>c(Ca2+)
C.迅速通入0.05 mol CO2后,关闭开关,久置后发现体系中沉淀减少
D.缓慢通入0.05 mol CO2的过程中,水的电离程度一直减小
查看答案和解析>>
科目: 来源: 题型:
【题目】最近,科学家成功研制出一种电源,该电源在消耗二氧化碳的同时,还可释放电能。电源电极为铝电极和多孔碳电极,电解质溶液为草酸盐溶液,放电过程中草酸盐浓度基本不变,电源示意图如图所示。下列有关该电源的说法正确的是
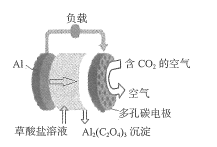
A.铝电极电势高于多孔碳电极
B.用该电源电解饱和食盐水,理论上,每消耗1mol二氧化碳可收集到标准状况下 11.2L 氢气
C.若生成0.5 mol 草酸铝,有3mol电子通过电解质溶液
D.正极的电极反应式为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com