
科目: 来源: 题型:
【题目】用NA 表示阿伏加德罗常数,下列叙述正确的是( )
A.常温常压下,4gH2含有的分子数为2NA
B.17g氨气所含电子数目为8NA
C.将1体积c1mol/L的硫酸溶于4体积水中 ,稀溶液的浓度为0.2c1mol/L
D.将5.85gNaCl 晶体溶入100mL水中,制得0.1mol/L的NaCl溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大。I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)![]() I3-(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )
I3-(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )

A. 反应I2(aq)+I-(aq)![]() I3 -(aq)的ΔH>0
I3 -(aq)的ΔH>0
B. 利用该反应可以除去硫粉中少量的碘单质
C. 在上述平衡体系中加入CCl4,平衡不移动
D. 25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
查看答案和解析>>
科目: 来源: 题型:
【题目】H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法不正确的是( )

A. 反应②比①要容易发生是因为反应②活化能大
B. 反应①和②均为放热反应
C. H2(g)+2ICl(g)= I2(g)+2HCl(g) H= -218 kJ·molˉ1
D. 反应①和②均为氧化还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
查看答案和解析>>
科目: 来源: 题型:
【题目】2019年10 月9 日诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。PC15、LiFePO4聚乙二醇、LiPF6、LiAsF6等可作制锂离子电池的材料。回答下列问题:
(l)Fe 的价层电子排布式为______________。Li、Fe、Cl、P 四种元素的第一电离能由大到小的顺序为___________________。
(2) PC13中心原子P 杂化类型是___________。将氨水和FeCl3 溶液混合后过滤出沉淀,再将沉淀溶入KOH 饱和溶液中,得到6 – 羟基配合物溶液,该配合物的化学式为_____。
(3)下列物质沸点最高的是_____________。
.A.正戊烷[ CH3 ( CH2)3CH3 ] B. l-丙醇 ( CH3 CH2 CH2OH)
C.乙二醇( HOCH2 CH2OH) . D. 丙醛( CH3CH2 CHO)
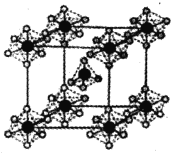
(4)熔融的PC15冷却后变为白色的离子晶体,晶体的晶胞如图所示,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,写出阴、阳离子的化学式 __________;正四面体形阳离子中键角大于PC13 的键角原因为______________。
(5)电池工作时,Li+ 沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图所示(X=P、As)。
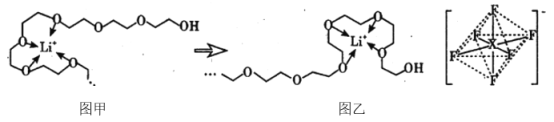
相同条件,Li+ 在LiAsF6 中比在LiPF6 中迁移较快,原因是 ________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤、氢气是常见能源,燃煤烟气中的氮硫氧化物要污染环境,氢气是一种清洁高效的新型能源,如何消除烟气中氮硫氧化物和经济实用的制取氢气成为重要课题。
(1)硫碘循环分解水是一种高效、环保的制氢方法,其流程图如图。
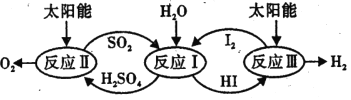
已知:
反应 I:2H2O (1)=2 H2(g) +O2(g) △H1 = +572kJmol-1
反应 II :H2SO4(aq) =SO2 (g) + H2O (l) +![]() O2 ( g) △H2= +327 kJ mol-1
O2 ( g) △H2= +327 kJ mol-1
反应 III:2 HI( aq)=H2 ( g) + I2(g) △H3 =+172k.Jmol-1
则反应SO2 (g)+I2 (g) + 2 H2O (l)=2 HI(aq) + H2SO4 (aq) △H =__________。
(2)用某氢化物 H2 R 高效制取氢气 ,发生的反应为2 H2R(g) ![]() R2(g) +2H2 ( g) 。
R2(g) +2H2 ( g) 。
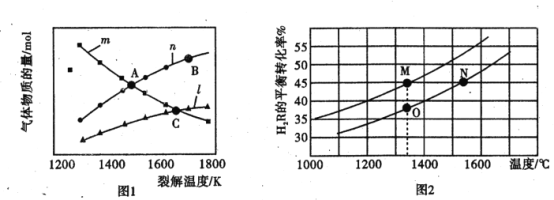
I.若起始时容器中只有H2R, 平衡时三种物质的物质的量与裂解温度的关系如图1。
①图中曲线n 表示的物质是__________(填化学式)。
②C点时,设容器内的总压为p Pa,则平衡常数KP =____________ (用平衡分压代替平衡浓度计算,分压 =总压×物质的量分数)。
II.若在两个等体积的恒容容器中分别加入2.0 mol H 2R、1. 0 molH2R,测得不同温度H2R的平衡转化率如图2 所示。
①M点和O正反应速率v( M) ________v( O) (填“>”“<”或“=”,下同)。
②M 、O 两点容器内的压强P(O)______2 P( M) 。
③平衡常数K( M)_____________K( N)。
(3)以连二硫酸根( S2O42-) 为媒介,使用间接电化学法处理燃煤烟气中的NO, 装置如图所示:
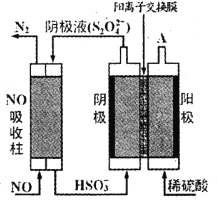
①从 A 口中出来的物质是________________。
②写出电解池阴极的电极反应式________________。
③用离子方程式表示吸收池中除去NO 的原理 ___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目: 来源: 题型:
【题目】2019 年 11 月《Science》杂志报道了王浩天教授团队发明的制取H2O2 的绿色方法,原理如图所示(已知:H2O2 ![]() H+ + H2O , Ka = 2. 4×10一12 )下列说法不正确的是
H+ + H2O , Ka = 2. 4×10一12 )下列说法不正确的是
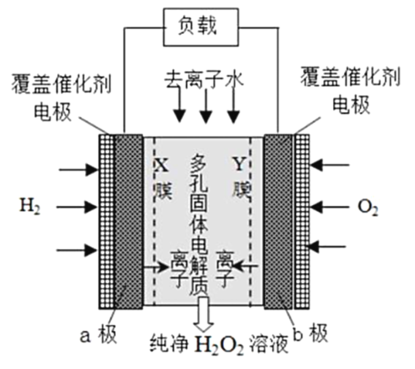
A.b 极上的电极反应为O2 +H2O +2e- =HO2 - +OH
B.X 膜为选择性阳离子交换膜
C.催化剂可促进反应中电子的转移,加快反应速率
D.每生成1 mol H2O2 电极上流过4 mole-
查看答案和解析>>
科目: 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入__________溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取a g样品,并设计用下图装置来测定过氧化钠的质量分数。
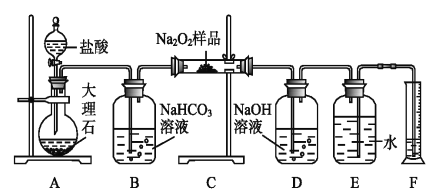
①A中发生反应离子方程式为_____________________。
②将仪器连接好以后,必须进行的第一步操作是_____________________。
③B装置出来的气体是否需要干燥_________________。(填“是”或“否”)
④写出装置C中发生的所有反应的化学方程式_____________,______________。
⑤D中NaOH溶液的作用_______________________。
⑥实验结束时,读取实验中生成气体的体积时,不合理的是_______________。
a.直接读取气体体积,不需冷却到室温
b.上下移动量筒,使得E、F中液面高度相同
c.视线与凹液面的最低点相平读取量筒中水的体积
⑦读出量筒内水的体积后,折算成标准状况下氧气的体积为V mL,则样品中过氧化钠的质量分数为__________________。
⑧实验完成后E到F之间导管内残留水的体积会使测量结果__________。(填“偏大”、“偏小”或“不影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com