
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
【答案】铁元素8Al+3Fe3O4 ![]() 4Al2O3+9FeFe3O4+8H+=2Fe3++Fe2+ +4H2OAl2O3+2NaOH=2NaAlO2+H2O生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色33.6
4Al2O3+9FeFe3O4+8H+=2Fe3++Fe2+ +4H2OAl2O3+2NaOH=2NaAlO2+H2O生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色33.6
【解析】
试题F是红褐色难溶于水的沉淀,因此F是氢氧化铁,则E是氢氧化亚铁,所以C和D分别是亚铁盐和铁盐。B和盐酸反应生成C和D,所以B是四氧化三铁,C是氯化亚铁,D是氯化铁,A在氧气中燃烧生成B,则A是铁。H和I均能与氢氧化钠溶液反应生成G,则I是铝,和四氧化三铁发生铝热反应生成铁和氧化铝,H是氧化铝,G是偏铝酸钠,据此分析解答。
解析:F是红褐色难溶于水的沉淀,因此F是氢氧化铁,则E是氢氧化亚铁,所以C和D分别是亚铁盐和铁盐。B和盐酸反应生成C和D,所以B是四氧化三铁,C是氯化亚铁,D是氯化铁,A在氧气中燃烧生成B,则A是铁。H和I均能与氢氧化钠溶液反应生成G,则I是铝,和四氧化三铁发生铝热反应生成铁和氧化铝,H是氧化铝,G是偏铝酸钠,则。
(1)根据以上分析可知A、B、C、D、E、F六种物质中所含的同一种元素的名称是铁。
(2)根据以上分析可知反应①的化学方程式为8Al+3Fe3O4 ![]() 4Al2O3+9Fe。反应③的离子方程式为Fe3O4+8H+=2Fe3++Fe2+ +4H2O;反应⑧的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O。
4Al2O3+9Fe。反应③的离子方程式为Fe3O4+8H+=2Fe3++Fe2+ +4H2O;反应⑧的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O。
(3)反应⑥是氢氧化亚铁被空气氧化,过程中的现象是生成的白色沉淀在空气中迅速变成灰绿色,最后变成红褐色。
(4)根据8Al+3Fe3O4 ![]() 4Al2O3+9Fe可知1mol铝发生反应后生成
4Al2O3+9Fe可知1mol铝发生反应后生成![]() 铁,铁在高温下与足量的水蒸气反应的方程式为3Fe+4H2O(g)
铁,铁在高温下与足量的水蒸气反应的方程式为3Fe+4H2O(g)![]() 4H2+Fe3O4,所以生成的气体换算成标准状况下为
4H2+Fe3O4,所以生成的气体换算成标准状况下为![]() 。
。


科目:高中化学 来源: 题型:
【题目】按要求完成下列各题:
(1)KOH的电子式:____________, CH(CH3)3的名称为:______________。
(2)有五种物质 :①Cu、②H2CO3、③BaSO4、④盐酸、⑤SO2,其中弱电解质是______(填序号,下同) ,非电解质是________________。
(3)钠与水反应的化学方程式为:_____________________。
已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入过量H2SO4,溶液立即变黄,试写出该反应的离子方程式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. c(N2):c(H2):c(NH3)=1:3:2
B. N2、H2和NH3的物质的量分数不再改变
C. N2与H2的物质的量之和是NH3的物质的量的2倍
D. 单位时间里每增加lmolN2,同时增加3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】mA(g)+nB(g)![]() pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )
pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )
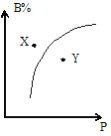
A.m+n>p
B.n>p
C.X点时混合物的正反应速率小于逆反应速率
D.X点比Y点混合物的反应速率慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于新制氯水的叙述正确的是( )
A.光照新制氯水有气泡逸出,该气体是Cl2B.新制氯水放置数天后酸性减弱
C.新制氯水中只含有Cl2和H2O两种分子D.新制氯水可使蓝色石蕊试纸先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值,下列说法正确的是
A. 在标准状况下,4.48L水中含有的分子数目为0.2NA
B. 0.1mol![]() 离子含有的电子、中子数均为1.0NA
离子含有的电子、中子数均为1.0NA
C. 一定条件下,0.1mol![]() 与0.3mol
与0.3mol![]() 充分反应后的0.1NA个分子
充分反应后的0.1NA个分子
D. 总物质的量为0.1mol的CaO和![]() 混合物中,所含离子总数为0.2NA
混合物中,所含离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将有铜的印刷线路板浸入200 mL氯化铁浓溶液中,有19.2 g铜被腐蚀掉。取出印刷线路板,向溶液中加入16.8 g铁粉,经充分反应,溶液中还存在9.6 g不溶解的物质。(设溶液体积不变)。请回答下列问题:
(1)充分反应后,溶液中存在9.6 g不溶物的成分为____。
(2)充分反应后溶液中一定不存在的金属离子为_____。
(3)比较Fe2+、Fe3+、Cu2+的氧化性大小:______。
(4)试计算最后溶液中Fe2+的物质的量浓度____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
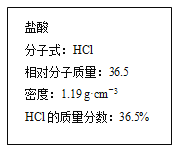
(1)该浓盐酸中HCl的物质的量浓度为________mol·L-1。
(2)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol/L稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。
②配制仪器除烧杯、玻璃棒、量筒,还需要的仪器是 _______、
③配制时,下列操作正确的顺序是(用字母表示)______。
A. 洗涤 B. 定容 C. 稀释 D. 摇匀 E. 冷却 F. 量取 G. 转移
④在配制过程中,下列实验操作使配制的稀盐酸的物质的量浓度偏小的是_______
A. 用量筒量取浓盐酸时俯视刻度线
B. 定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
C. 配制时,容量瓶有少量蒸馏水
D. 定容时俯视容量瓶的刻度线
E. 转移完溶液后未洗涤玻璃棒和烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在常温常压下:
①CH3OH(l)+ O2(g)=CO(g)+ 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________________________ 。
(2)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
容器 | 甲 |
反应物投入量 | 1mol CO2(g)和3mol H2(g) |
平衡时c(CH3OH) | c1 |
平衡时能量变化 | 放出29.4kJ |
若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是_____mol/(L·s)。
(3)铅蓄电池放电时总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。铅蓄电池放电时的正极反应式为____ ,当电路中有0.2mol电子转移时,理论上两电极质量变化的差为_______ g。
(4)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
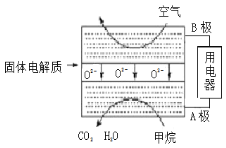
①A极电极反应式为____________________。
②若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中O2体积为20%),则理论上消耗甲烷________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com