
【题目】(1)已知在常温常压下:
①CH3OH(l)+ O2(g)=CO(g)+ 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________________________ 。
(2)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
容器 | 甲 |
反应物投入量 | 1mol CO2(g)和3mol H2(g) |
平衡时c(CH3OH) | c1 |
平衡时能量变化 | 放出29.4kJ |
若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是_____mol/(L·s)。
(3)铅蓄电池放电时总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。铅蓄电池放电时的正极反应式为____ ,当电路中有0.2mol电子转移时,理论上两电极质量变化的差为_______ g。
(4)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
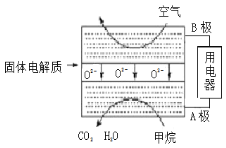
①A极电极反应式为____________________。
②若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中O2体积为20%),则理论上消耗甲烷________mol。
【答案】![]() △H= 265.2kJ/mol 0.03
△H= 265.2kJ/mol 0.03 ![]() 3.2
3.2 ![]() 0.025
0.025
【解析】
⑴甲醇燃烧热是1mol甲醇完全燃烧生成稳定的液态水,将① + 0.5![]() ② - 2
② - 2![]() ③得其热化学方程式。
③得其热化学方程式。
⑵一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol。
1mol 49 kJ
x mol 29.4kJ
1:x = 49:29.4
解得x = 0.6mol
若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是![]() 。
。
⑶分析得出正极为PbO2,得到电子变为硫酸铅,其放电时的正极反应式为PbO2 + 2e- + 4H+ + SO42- = PbSO4 + 2H2O,当电路中有0.2mol电子转移时,
负极
2mol:0.2mol = 96g:yg
解得y = 9.6g
正极
2mol:0.2mol = 64g:zg
解得z = 6.4g
理论上两电极质量变化的差为9.6g-6.4g = 3.2 g。
⑷①A极是甲烷作负极,其电极反应式为CH4 - 8e- + 4O2- = 2H2O + CO2。
②若燃料电池消耗的空气在标准状况下的体积是5.6L即空气物质的量为0.25mol,则氧气物质的量为0.05mol,转移电子物质的量为0.2mol,再计算理论上消耗甲烷。
⑴甲醇燃烧热是1mol甲醇完全燃烧生成稳定的液态水,将① + 0.5② - 2③得其热化学方程式CH3OH(l) + 1.5O2(g) = CO2(g) + 2 H2O(l) ΔH=﹣726.0 kJ∕mol,故答案为:CH3OH(l) + 1.5O2(g) = CO2(g) + 2 H2O(l) ΔH=﹣726.0 kJ∕mol。
⑵一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol。
CH3OH(g)+H2O(g) △H=-49.0kJ/mol。
1mol 49 kJ
x mol 29.4kJ
1:x = 49:29.4
解得x = 0.6mol
若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是![]() ,故答案为:0.03。
,故答案为:0.03。
⑶铅蓄电池放电时总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。正极为PbO2,得到电子变为硫酸铅,其放电时的正极反应式为PbO2 + 2e- + 4H+ + SO42- = PbSO4 + 2H2O,当电路中有0.2mol电子转移时,
负极
2mol:0.2mol = 96g:yg
解得y = 9.6g
正极
2mol:0.2mol = 64g:zg
解得z = 6.4g
理论上两电极质量变化的差为9.6g-6.4g = 3.2 g,故答案为3.2g。
⑷①A极是甲烷作负极,其电极反应式为CH4 - 8e- + 4O2- = 2H2O + CO2,故答案为:CH4 - 8e- + 4O2- = 2H2O + CO2。
②若燃料电池消耗的空气在标准状况下的体积是5.6L即空气物质的量为0.25mol,则氧气物质的量为0.05mol,转移电子物质的量为0.2mol,则理论上消耗甲烷![]() ,故答案为:0.025。
,故答案为:0.025。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些氮的化合物是引起大气污染、水体污染和土壤污染原因之一。
I.汽车和工业废气中的氮氧化物是城市空气污染的主要来源。氮氧化物处理通常有下列途径:
(1)在汽车排气管内安装催化转化器,其反应为2NO(g) +2CO(g)= 2CO2(g) +N2(g)。
①该反应能够正向自发进行,则正反应的ΔH_________0(填“>”或“<”)。
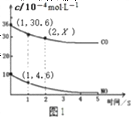
②根据传感器记录某温度下,NO、CO的反应进程,测量所得数据绘制出图1。前1s内平均反应速率v(N2)=__________mol/(L·s);第2s时的X值范围_________________________。
(2)烟气中的氮氧化物(NOx)可与甲烷在一定条件下反应转化为无害成分,从而消除污染。已知
反应 | 反应热(△H/kJ·mol-1) | 平衡常数(K) |
CH4(g)+2O2(g)═CO2(g)+2H2O(l) | a | K1 |
N2(g)+O2(g)═2NO(g) | b | K2 |
则CH4脱硝的热化学方程式为CH4(g) + 4NO (g)![]() CO2(g) + 2N2(g) + 2H2O (l)ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
CO2(g) + 2N2(g) + 2H2O (l)ΔH=_________kJ/mol(用a、b表示);平衡常数K3=_________(用K1、K2表示)。
II.氰化钠是一种重要的基本化工原料。“天津港”爆炸中,氰化钠产生泄漏,为了避免给土壤和水体带来污染,消防员通过喷洒双氧水来处理泄漏的氰化钠。
(3)已知:NaCN + H2O2+ H2O=NaHCO3+ NH3↑,用H2O2处理1mol NaCN时,反应中转移电子的物质的量为_________mol(NaCN中C为+2价)。
(4)某兴趣小组检测处理后的氰化钠废水是否达标。
已知:①废水中氰化钠的最高排放标准为0.50 mg/L。
②Ag++2CN-= [Ag(CN)2]-,Ag++I-= AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
③实验如下:取30.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000×10-4mol/L的AgNO3标准溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
④滴定终点的判断方法是_________。
⑤经计算处理后的废水中NaCN的浓度为_________mg/L(保留两位小数),处理后的废水是否达到排放标准:________(填“是”或“否”)
III.工业废水中,含有NaNO2。NaNO2固体外观酷似食盐,误食会中毒。可用电解法将废水中少量的![]() 转化为N2以降低其危害。写出
转化为N2以降低其危害。写出![]() 在酸性条件下转化为氮气的电极反应式为_____________。
在酸性条件下转化为氮气的电极反应式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新制饱和氯水中,若只改变某一条件,下列叙述正确的是
A. 再通入少量氯气,![]() 减小
减小
B. 通入少量SO2,溶液漂白性增强
C. 加入少量的碳酸氢钠粉末,pH增大,溶液漂白性增强
D. 光照过程中,有气泡冒出,溶液的导电性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子晶体的数据大小比较不正确的是
A. 熔点:NaF>MgF2>AlF3B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaClD. 硬度:MgO>CaO>BaO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对教材中铜与浓硫酸的实验作出如下改进。实验装置如图所示(加热和夹持装置已略去)。
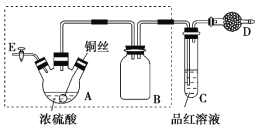
实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检查虚线框内装置气密性的方法是____________________________。
(2)装置A的名称是________,装置B的作用是_________,装置D中所盛药品是__________。
(3)装置A中发生反应的化学方程式为____________________________。
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是__________。
(5)实验后装置A中有白色固体产生,将装置A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是______________;不可直接向装置A中加水的原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为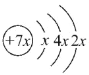 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)A为____(写出元素符号,下同);
(2)B为____,简化电子排布式是____;
(3)C为____,核外电子排布式是____;
(4)D为____,轨道表示式是____;
(5)E原子结构示意图是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所混有的少量杂质,括号内为杂质。指明应加入的试剂,写出有关方程式。
(1)Fe粉(Al粉):试剂___离子方程式___;
(2)FeCl2溶液(FeCl3):试剂___离子方程式___;
(3)Na2CO3固体(NaHCO3):化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是
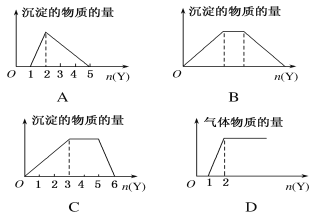
A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com