
【题目】mA(g)+nB(g)![]() pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )
pC(g)△H<0,室温条件下,在一容积不变的密闭容器中加入一定量的A、B,B%与压强(P)的关系如图所示,则下列有关叙述正确的是( )
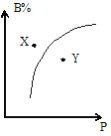
A.m+n>p
B.n>p
C.X点时混合物的正反应速率小于逆反应速率
D.X点比Y点混合物的反应速率慢
【答案】D
【解析】
曲线上的点都是平衡点,由图可知,压强越大,B的百分含量越高,说明增大压强平衡向逆反应移动;X点B的百分含量高于相同压强平衡点的含量,说明X点未到达平衡状态,反应向正反应移动,Y点B的百分含量低于相同压强平衡点的含量,说明Y点未到达平衡状态,反应向逆反应移动。
A、压强越大,B的百分含量越高,说明增大压强平衡向逆反应移动,故m+n<p,故A错误;
B、压强越大,B的百分含量越高,说明增大压强平衡向逆反应移动,故m+n<p,故B错误;
C、X点B的百分含量高于相同压强平衡点的含量,说明X点未到达平衡状态,反应向正反应移动,所以正反应速率大于逆反应速率,故C错误;
D、X点比Y点的压强小,所以X点比Y点混合物的反应速率慢,故D正确;
故选D。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、N、M六种主族元素,它们在周期表中位置如图所示,下列说法不正确的是

A. 原子半径:Y>Z>W
B. 单质的还原性:X>Y
C. 溴与元素M同主族,最高价氧化物的水化物的酸性比M的强
D. 元素N位于金属与非金属的分界线附近,可以推断N元素的单质可作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或所得实验结论一致的是
选项 | 实验操作和现象 | 预期实验目的或结论 |
A | 比较Cl2与H2SO4氧化性强弱 | 向漂白粉中加入4mol·L-1硫酸,观察有无黄绿色气体 |
B | 向浓度均为0.10molL-1的KCl和KI混合溶液中滴加少量AgNO3稀溶液,出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3- |
D | 向苯酚钠溶液中通入CO2,溶液变浑浊 | 结合H+能力: C6H5O->CO32- >HCO3- |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中时刻存在着氮的转化。实现氮按照一定方向转化一直是科学领域研究的重要课题,如图为N2分子在催化剂的作用下发生的一系列转化示意图:
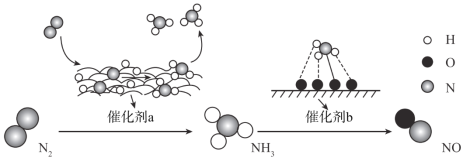
下列叙述正确的是
A.N2![]() NH3,NH3
NH3,NH3![]() NO均属于氮的固定
NO均属于氮的固定
B.催化剂a作用下氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.使用催化剂a、b均可以提高单位时间内生成物的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个真空恒容密闭容器中盛有1molPCl5,加热到200℃时发生如下反应:PCl5(气) ![]() PCl3(气)+Cl2(气),反应达到平衡时,混合气体中PCl5所占体积分数为M%. 若在同一温度和同一容器中,最初投入是2molPCl5,反应达平衡时,混合气体中PCl5所占体积分数为N%.则M和N的关系 ( )
PCl3(气)+Cl2(气),反应达到平衡时,混合气体中PCl5所占体积分数为M%. 若在同一温度和同一容器中,最初投入是2molPCl5,反应达平衡时,混合气体中PCl5所占体积分数为N%.则M和N的关系 ( )
A. 大于B. 小于C. 等于D. 不能肯定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向mg镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL。向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng。再将得到的沉淀灼烧至质量不再改变为止,得到固体pg。则下列关系不正确的是
A. ![]() B.
B. ![]() C. n=m+17Vc D.
C. n=m+17Vc D. ![]() m<p<
m<p<![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
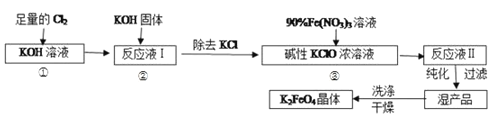
已知:①2KOH+Cl2=KCl+KClO+H2O(条件:温度较低)
②6KOH+3Cl2=5KCl+KClO3+3H2O(条件:温度较高)
③K2FeO4在水溶液中易水解:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2↑
4Fe(OH)3(胶体)+8OH-+3O2↑
回答下列问题:实验室可利用如图装置完成流程①和②

(1)写出工业上制取Cl2的化学方程式__;两水槽中的水为___(填“热水”或“冷水”)。
(2)反应一段时间后,停止通氯气,再往仪器a中加入浓KOH溶液的目的是___;
A.为下一步反应提供碱性的环境
B.使KClO3转化为 KClO
C.与溶液I中过量的Cl2继续反应,生成更多的KClO
D.KOH固体溶解时会放出较多的热量,有利于提高反应速率
(3)从溶液Ⅱ中分离出 K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子方程式为:___。
(4)用重结晶法提纯粗产品:将粗产品先用KOH稀溶液溶解,再加入饱和的KOH溶液,冷却结晶,过滤,用少量异丙醇洗涤,最后低温真空干燥。
①洗涤粗品时选用异丙醇而不用水的理由是___。
②如何判断 K2FeO4 晶体已经洗涤干净__。
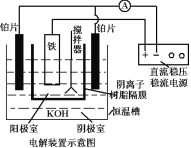
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图,电解过程中阳极的电极反应式为___。
(6)FeO42-在水溶液中的存在形态如图所示。下列说法正确的是___。
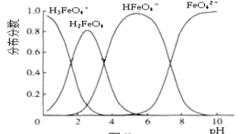
A.不论溶液的酸碱性如何变化,铁元素都有4 种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数逐渐增大
C.向pH=6 的这种溶液中加KOH溶液,发生反应的离子方程式为HFeO4-+OH-=FeO42- +H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在新制饱和氯水中,若只改变某一条件,下列叙述正确的是
A. 再通入少量氯气,![]() 减小
减小
B. 通入少量SO2,溶液漂白性增强
C. 加入少量的碳酸氢钠粉末,pH增大,溶液漂白性增强
D. 光照过程中,有气泡冒出,溶液的导电性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com