
科目: 来源: 题型:
【题目】铜碘杂化团簇具有优异的光学性能,可用于制备发光二极管、发光墨水、生物成像仪器等。一种铜碘杂化团簇的合成路线如图:
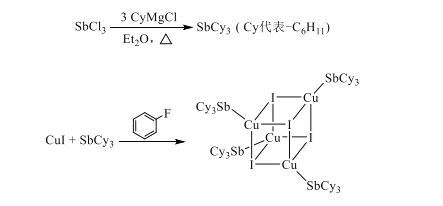
(1)已知SbCl3(三氯化锑)是挥发性显著的物质,由此判断SbCl3中主要含有的化学键类型是___。
(2)Sb为第四周期VA族元素,预测SbCl3的立体结构为___。
(3)Et2O(CH3CH2OCH2CH3,乙醚)中氧原子以及![]() 中碳原子的杂化类型分别是___、___。
中碳原子的杂化类型分别是___、___。
(4)CuI中Cu+的核外电子排布式为___。
(5)SbCy3只能与一个Cu+配位的原因是___。
(6)已知上述铜碘杂化团簇属四方晶系,晶胞参数分别为anm、bnm、cnm,棱间夹角为α=β=γ=90°,平均一个晶胞含有一个铜碘杂化团簇,该团簇的化学式为___。设阿伏加德罗常数的值为NA,已知SbCy的相对分子量是371,则该铜碘杂化团簇的密度是___g·cm-3(列计算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲苯(C7H8)和二甲苯(C8H10)是重要的化工原料。利用苯(C6H6)和甲醇(CH3OH)在催化剂作用下反应得到C7H8、C8H10和副产物三甲苯(C9H12),发生的主要反应如下:
Ⅰ.C6H6(g)+CH3OH(g)C7H8(g)+H2O(g)
Ⅱ.C7H8(g)+CH3OH(g)C8H10(g)+H2O(g)
Ⅲ.C8H10(g)+CH3OH(g)C9H12(g)+H2O(g)
(1)500℃、0.18Mpa条件下,反应达到平衡时,结果如图所示。
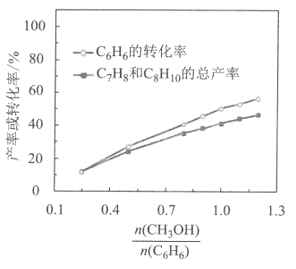
①由图分析,随着投料比![]() 增加,CH3OH的平衡转化率___,平衡时
增加,CH3OH的平衡转化率___,平衡时![]() 的值___。(填“增大”、“减小”或“不变”)
的值___。(填“增大”、“减小”或“不变”)
②投料比![]() 为1.0时,C6H6的平衡转化率为50%,产物中C7H8、C8H10和C9H12物质的量之比为6︰3︰1。CH3OH的平衡转化率为___,反应I的平衡常数K=___。
为1.0时,C6H6的平衡转化率为50%,产物中C7H8、C8H10和C9H12物质的量之比为6︰3︰1。CH3OH的平衡转化率为___,反应I的平衡常数K=___。
(2)我国学者结合实验与计算机模拟结果,研究了反应I在固体酸(HB)催化剂表面进行的反应历程如图所示。其中吸附在固体酸(HB)表面的物种用*标注。
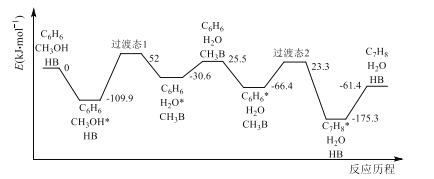
①反应I的H=___kJ·mol-1。
②吸附CH3OH的焓变___吸附C6H6的焓变(填“>”或“<”)。
③C6H6*在催化剂表面转化为C7H8*的反应方程式为___。
④在固体酸(HB)催化作用下,测得反应I的速率方程为v=kp(C6H6)(k为速率常数)。在刚性容器中发生反应I,关于反应I的平衡常数(K)和反应速率(v)的叙述正确的是__(填标号)。
A.升高温度,K和v均增大
B.增大p(C6H6),K不变,v增大
C.降低温度,K和v均减小
D.增大p(CH3OH),K不变,v增大
查看答案和解析>>
科目: 来源: 题型:
【题目】柔红酮是一种医药中间体,其结构简式如图所示。下列说法正确的是( )
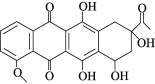
A.每个柔红酮分子中含有2个手性碳原子
B.一定条件下柔红酮可发生消去、氧化、加成、取代反应
C.1 mol柔红酮最多可与2 mol Br2发生取代反应
D.柔红酮分子中所有的碳原子有可能都在同一个平面上
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ka(CH3COOH)=1.7×10-5,Kb(NH3·H2O)=1.7×10-5。常温下,用0.01mol·L-1氨水滴定20mL浓度均为0.01mol·L-1的HCl和CH3COOH混合溶液,相对导电能力随加入氨水体积变化曲线如图所示。下列叙述错误的是( )
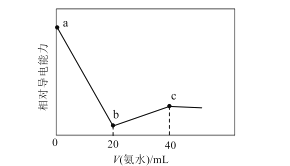
A.a点的混合溶液中c(CH3COO-)约为1.7×10-5mol·L-1
B.b点的混合溶液中:c(CH3COOH)>c(NH4+)
C.c点的混合溶液中:c(NH4+)+c(NH3·H2O)=c(Cl-)+c(CH3COO-)+c(CH3COOH)
D.混合溶液pH=7时,加入氨水体积大于40mL
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物是重要的化工原料
(1)利用图所示装置及药品制取氨气。
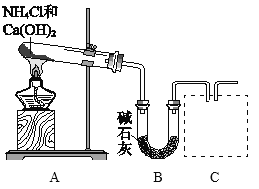
①A中制氨气的化学方程式是________。
②C处是用集气瓶收集氨气的装置,请绘出装置图。________
③证明氨气已集满的操作和现象是________。
(2)氨经催化氧化可制备硝酸,其过程中涉及如下反应。4NH3 + 5O2 ![]() 4NO + 6H2O
4NO + 6H2O
①作为氧化剂的物质是______,氮元素的化合价______(填“升高”或“降低”)。
②若反应中消耗了4 mol NH3,则生成NO的物质的量为______ mol,转移电子的物质的量为______ mol。
(3)含氮废水会加速藻类和其他浮游生物的大量繁殖,使水质恶化。利用微生物对含氮废水进行处理的流程如下:
![]()
请回答:
①过程Ⅲ发生化合反应的化学方程式为______。
②根据图1和图2,推断使用亚硝化菌的最佳条件为______。
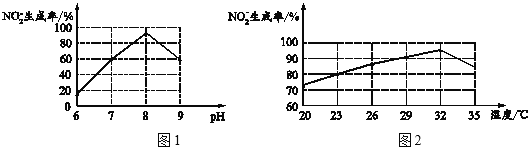
③利用微生物处理含氮废水的优点为______。
查看答案和解析>>
科目: 来源: 题型:
【题目】由物质a为原料,制备物质d(金刚烷)的合成路线如图所示。关于图中有机物说法中错误的是( )
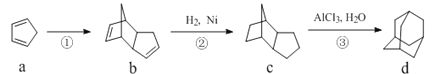
A.物质c与物质d互为同分异构体
B.物质b的分子式为C10H12,既能发生加成反应也能发生取代反应
C.物质a中所有原子都在同一个平面上
D.物质d的一氯代物有3种
查看答案和解析>>
科目: 来源: 题型:
【题目】“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为Na2CO3)吸收烟气中的SO2,得到亚硫酸钠(Na2SO3)粗品。其流程如下,下列说法正确的是
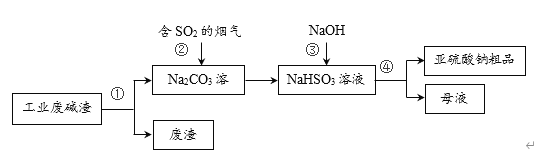
A.操作①、④均为过滤
B.步骤②中发生了置换反应
C.步骤③发生的反应为:NaHSO3+NaOH = Na2SO3+H2O
D.亚硫酸钠粗品中不可能含有Na2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学探究金属Na与CO2的反应,实验如下:
实验I | 实验II | |
操作 | 将点燃的金属钠伸到盛有CO2的集气瓶中 | 将实验I的集气瓶用水冲洗,过滤。取黑色滤渣灼烧;取滤液分别滴加酚酞和氯化钡溶液 |
现象 | ①火焰呈黄色 ②底部有黑色固体,瓶壁上附有白色固体 | ①黑色滤渣可燃 ②滤液能使酚酞溶液变红,滴加氯化钡溶液有白色沉淀生成 |
下列说法不正确的是
A. 生成的黑色固体中含有CB. 白色固体是Na2O
C. 实验说明CO2具有氧化性D. 金属Na着火不能用CO2灭火
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中,正确的是
A.36 g H2O的物质的量为1 mol
B.常温常压下,1mol Cl2的体积是22.4 L
C.0.5mol·L-1NaCl溶液中含有0.5mol Na+
D.1molCO2中含有的分子数约为6.02×1023
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家研发了一种水系可逆Zn-CO2电池,将两组阴离子、阳离子复合膜反向放置分隔两室电解液,充电、放电时,复合膜层间的H2O解离成H+和OH-,工作原理如图所示。下列说法错误的是( )
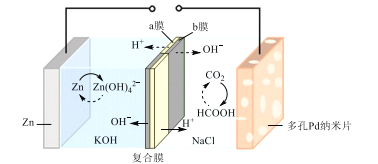
A.a膜是阳离子膜,b膜是阴离子膜
B.放电时负极的电极反应式为Zn+4OH--2e-=Zn(OH)42-
C.充电时CO2在多孔Pd纳米片表面转化为甲酸
D.外电路中每通过1mol电子,复合膜层间有1mol H2O解离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com