
科目: 来源: 题型:
【题目】活动小组同学用下图1装置进行实验,试回答下列问题。
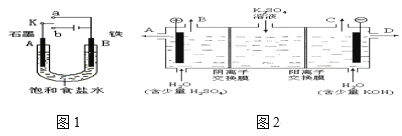
(1)若开始时开关K与a连接,则A极的电极反应式为____。
(2)若开始时开关K与b连接,则A极的电极反应式为____。
(3)当开关K与b连接时,关于这个实验,下列说法正确的是(填序号)____。
A.溶液中Na+向A极移动
B.从A极处逸出的气体能使湿润KI淀粉试纸变蓝
C.反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
(4)该小组同学认为,如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①制得的氢氧化钾溶液从出口(填“A”、“B”、“C”、“D”)___导出,制得的氧气从出口(填“A”、“B”、“C”、“D”)___导出。
②此时通过阴离子交换膜的离子数___(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数。
③通电开始后,阴极附近溶液pH会增大,请简述原因___。
查看答案和解析>>
科目: 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是( )
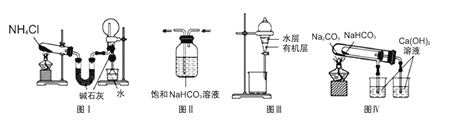
A.图I用于实验室制取氨气并收集干燥的氨气
B.图II用于除去CO2中含有的少量HCl
C.图III用于提取I2的CCl4溶液中的I2
D.图IV装置用于验证NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳经济”备受关注,CO2的捕捉、排集、利用成为科学家研究的重要课题。太空舱产生的 CO2用下列反应捕捉,以实现 O2的循环利用。
Sabatier 反应:CO2(g)+4H2(g)CH4(g)+2H2O(g)
水电解反应:2H2O(l)![]() 2H2(g)+O2(g)
2H2(g)+O2(g)
(1)将原料气按 n(CO2)∶ n(H2)=1∶4 置于密闭容器中发生 Sabatier 反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
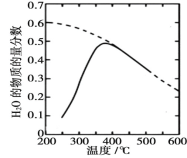
①该反应的平衡常数 K 随温度升高而________(填“增大”或“减小”)。
②温度过高或过低均不利于该反应的进行,原因是________。
③下列措施能提高 CO2 转化效率的是________(填标号)。
A. 适当减压
B. 增大催化剂的比表面积
C. 反应器前段加热,后段冷却
D. 提高原料气中 CO2 所占比例
E. 合理控制反应器中气体的流速
(2)将一定量的 CO2(g)和 CH4(g)通入一恒容密闭容器中发生反应:CO2(g)+CH4(g)2CO(g)+2H2(g) Δ H =+248 kJ·mol-1。
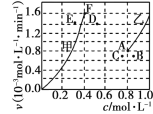
为了探究该反应的反应速率与浓度的关系,起始时向恒容密闭容器中通入CO2 与CH4 ,使其物质的量浓度均为1.0mol·L-1,平衡时,根据相关数据绘制出两条反应速率与浓度关系曲线如图, v正~ c(CH4)和 v逆 ~ c(CO)。则与 v正~ c (CH4)相对应曲线是图中________(填“甲”或“乙”);该反应达到平衡后,某一时刻降低温度反应重新达到平衡,则此时曲线甲对应的平衡点可能为________(填“D”“E”或“F”)。
(3)用稀氨水喷雾捕集 CO2最终可得产品NH4HCO3。在捕集时,气相中有中间体 NH2COONH4(氨基甲酸铵)生成。现将一定量纯净的氨基甲酸铵置于恒容密闭容器中,分别在不同温度下进行反应:NH2COONH4(s) 2NH3(g)+CO2 (g)。实验测得的有关数据见下表( t1 < t2 < t3 )
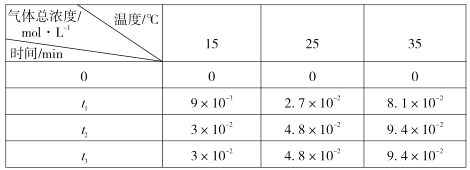
氨基甲酸铵分解反应是________(填“放热”或“吸热”)反应。15℃时此反应的化学平衡常数 K =________。
(4)一种新的循环利用方案是用 Bosch 反应 CO2(g)+2H2(g) C(s)+2H2O(g)代替 Sabatier 反应。
① 已知 CO2(g)、H2O(g)的生成焓分别为–394 kJmol-1 、–242 kJmol-1 ,Bosch 反应的Δ H =________kJmol-1(生成焓指一定条件下由对应单质生成 1mol 化合物时的反应热)。
②一定条件下 Bosch 反应必须在高温下才能启动,原因是________。
③该新方案的优点是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是一种新型离子化合物,该物质由两种阳离子和两种阴离子构成,其中有一种 18 电子离子和两种 10 电子离子。W、X、Y、Z 均为短周期元素,且均不在同一主族。下列说法不正确的是
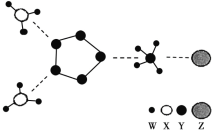
A.X 与 W 形成的化合物沸点高于 X 同族元素与 W 形成的化合物
B.Z 的最高价氧化物对应水化物的酸性比 Y 的强
C.Y 气态氢化物的稳定性比 X 的强
D.如图化合物中,存在极性共价键和非极性共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】太阳能电池在日常生活中已广泛应用,一种替代硅光电池的全天候太阳能电池已投入商用,其工作原理如图。下列说法不正确的是()
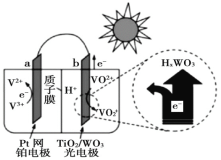
A.硅太阳能电池工作原理与该电池不相同
B.夜间时,该电池相当于蓄电池放电,a 极发生氧化反应
C.光照时,b 极的电极反应式为VO2+﹣e﹣+H2O=VO![]() +2H+
+2H+
D.光照时,每转移 1mol 电子,有 2 mol H+ 由 b 极区经质子交换膜向 a 极区迁移
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下向 100 mL 蒸馏水中滴入10 mL 5 mol·L-1HA溶液,利用传感器测得溶液中 c (H+)和温度随着加入 HA 溶液体积的变化曲线如图所示,下列有关说法正确的是
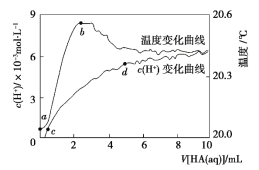
A.HA 是强酸
B.a ~ b 段,HA 电离放热,使溶液温度升高
C.c ~ d 段, c (H+)增大,HA 电离程度增大
D.c 点时,加入等体积等浓度的 NaOH 溶液,则 c (Na+)= c (A-)+ c (HA)
查看答案和解析>>
科目: 来源: 题型:
【题目】CO2 和 CH4 重整可制备合成气,催化重整反应历程示意图如下:
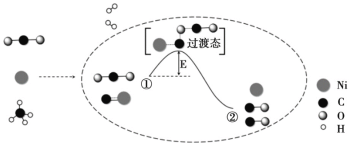
下列说法不正确的是
A.Ni 在该反应中做催化剂,参与化学反应
B.①→②吸收能量
C.①→②既有碳氧键的断裂,又有碳氧键的形成
D.合成气的主要成分为 CO 和 H2
查看答案和解析>>
科目: 来源: 题型:
【题目】侯氏制碱法在我国工业发展中具有重要作用。现某学习小组在实验室中利用下列反应装置模拟侯氏制碱法制备 NaHCO3,反应原理为 NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。下列说法正确的是
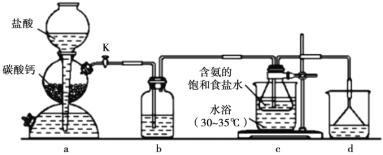
A.装置 a 中可改用碳酸钙粉末提高反应速率
B.装置 b、d 依次盛装饱和 Na2CO3 溶液、稀硫酸
C.装置 c 中含氨的饱和食盐水提高了 CO2 吸收效率
D.反应后将装置 c 中的锥形瓶充分冷却,蒸发结晶得到 NaHCO3 晶体
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积一定的密闭容器中,可逆反应:A2(g)+B2(g)![]() xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是
xC(g)符合下列图Ⅰ所示关系,由此推断对图Ⅱ的正确说法是

A.P3<P4,Y轴表示A2的转化率
B.P3>P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度
D.P3>P4,Y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com