
【题目】用下列实验装置进行相应的实验,能达到实验目的的是( )
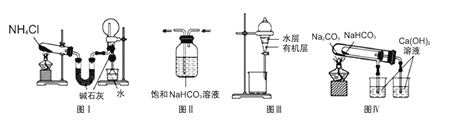
A.图I用于实验室制取氨气并收集干燥的氨气
B.图II用于除去CO2中含有的少量HCl
C.图III用于提取I2的CCl4溶液中的I2
D.图IV装置用于验证NaHCO3和Na2CO3的热稳定性
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
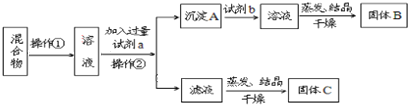
(1)操作①的名称是___________,操作②的名称是____________。
(2)试剂a是___________试剂b是___________,固体B是___________。(填化学式)
(3)加入试剂a所发生的离子方程式为:______________________。加入试剂b所发生的离子方程式为:_____________________。
(4)该方案能否达到实验目的:_______.若不能,应如何改进(若能,此问不用回答)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。
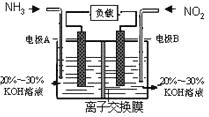
下列说法不正确的是
A. 电流从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为:2NH3-6e-=N2+6H+
D. 当有4.48LNO2(标准状况) 被处理时,转移电子为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中溴元素以Br﹣形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
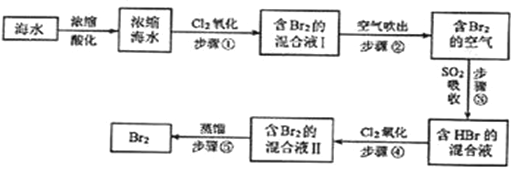
请回答下列问题.
(1)将海水浓缩的方法是__;
(2)步骤①反应的离子方程式是__,1molCl2参加反应,转移电子__mol;
(3)步骤②通入热空气吹出Br2,利用了Br2的__(填序号);
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)步骤③中用SO2的水溶液吸收Br2,吸收率可达95%,该反应的氧化剂是__,在工业生产中此步骤应解决的问题是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸亚铁,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与![]() ,反应得富马酸亚铁。
,反应得富马酸亚铁。
已知:
物质名称 | 化学式 | 相对分子质量 | 电离常数(25℃) |
富马酸 |
| 116 |
|
碳酸 |
|
| |
富马酸亚铁 | FeC4H2O4 | 170 |
i.制备富马酸亚铁:
①将富马酸置于100mL烧杯A中,加热水搅拌
②加入![]() 溶液10mL使溶液pH为6.5-6.7。并将上述溶液移至100mL容器B中
溶液10mL使溶液pH为6.5-6.7。并将上述溶液移至100mL容器B中
③安装好回流装置C,加热至沸。然后通过恒压滴液漏斗D缓慢加入![]() 溶液30mL
溶液30mL
④维持反应温度100℃,充分搅拌1.5小时。冷却,减压过滤,用水洗涤沉淀
⑤最后水浴干燥,得棕红(或棕)色粉末,记录产量
请回答以下问题:
(1)该实验涉及到的主要仪器需从以上各项选择,则B为__________(填字母),C为___________(填名称)。
(2)已知反应容器中反应物![]() 和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入
和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入溶液调节pH的目的是______________________________________________;若加入
![]() 溶液过量,溶液pH偏高,则制得产品的纯度会_____________(填“偏高”“偏低”或“无影响”)。
溶液过量,溶液pH偏高,则制得产品的纯度会_____________(填“偏高”“偏低”或“无影响”)。
(3)配制![]() 溶液方法为称取
溶液方法为称取![]() 固体,溶于30mL新煮沸过的冷水中,需用新煮沸过的冷水的原因是____________________________________________________________________________。
固体,溶于30mL新煮沸过的冷水中,需用新煮沸过的冷水的原因是____________________________________________________________________________。
(4)步骤④中洗涤的目的主要是为了除去是___________离子,检验沉淀是否洗净的方法是:_____________。
ii.计算产品的产率:
(5)经测定,产品中富马酸亚铁的纯度为76.5%。以5.80g富马酸为原料反应制得产品8.10g,则富马酸亚铁的产率为_____________%。(保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2O2(l)═2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是

A. 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰
B. 2molH2O2(l)的能量高于2molH2O(l)的能量
C. 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ
D. 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出)。已知H为固态氧化物,F是红褐色难溶于水的沉淀,且A、B、C、D、E、F六种物质中均含同一种元素。

请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含的同一种元素的名称是________。
(2)反应①的化学方程式为_____________________________________
反应③的离子方程式为________________________
反应⑧的化学方程式为_____________________________________
(3)反应⑥过程中的现象是______________________________。
(4)1molI发生反应后生成的A高温下与足量的水蒸气反应,生成的气体换算成标准状况下占______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是制造干电池的主要原料之一,也是中学化学中常见的一种试剂。工业上Mn(NO3)2和KMnO4为原料制备MnO2,其生产原理如下:用软锰矿(含MnO2和少量的Fe2O3、SiO2)和碳反应制得MnO;再将MnO与稀硝酸反应,反应后经过滤、提纯、浓缩,可制得50%的Mn(NO3)2溶液;在一定条件下,把50%的Mn(NO3)2溶液滴加到KMnO4溶液中,发生如下反应:3Mn(NO3)2+2KMnO4+2H2O═5MnO2↓+2KNO3+4HNO3,反应生成的沉淀经过滤、洗涤、干燥后得到MnO2。
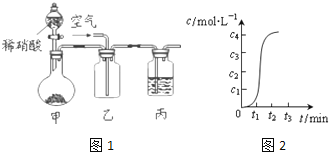
请回答下列问题:
Ⅰ、若将软锰矿和碳反应后的固体产物置于如图1所示的装置甲中,与稀硝酸反应,观察到装置乙中有红棕色气体产生。
(1)写出甲中产生气体反应的化学方程式___。
(2)在制备MnO2的实验中要向反应混合液中不断滴加氨水,则氨水的作用是___。
Ⅱ、有人提出用日光分解KMnO4溶液的方法可制取MnO2,反应方程式为:4KMnO4+2H2O![]() 4MnO2↓+4KOH+3O2↑该反应中c(OH-)随时间的变化曲线如图2所示,分析曲线的变化趋势,你认为形成该变化的原因是___。
4MnO2↓+4KOH+3O2↑该反应中c(OH-)随时间的变化曲线如图2所示,分析曲线的变化趋势,你认为形成该变化的原因是___。
Ⅲ、某兴趣小组通过实验研究MnO2的氧化性进行了一系列的研究。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是___。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。
实验 | 酸或碱 | 现象 |
A | 1滴0.2mol/LNaOH溶液 | 不变色 |
B | 1滴水 | 缓慢变浅棕褐色 |
C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |
该小组从上述对比实验中,可以得出的结论是___。写出在MnO2迅速氧化I的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分加热如图所示的密闭容器中放置有固体试剂的两个位置, 若钠与氧化银均反应完全且恢复到原来的温度,U形管左右两侧液面相平。下列有关说法中错误的是

A. 反应前后装置内空气的成分保持不变
B. 反应前装置内钠与Ag2O物质的量之比为2:1
C. 热稳定性:生成的钠的氧化物强于Ag2O
D. 反应后有淡黄色固体生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com