
【题目】海水中溴元素以Br﹣形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
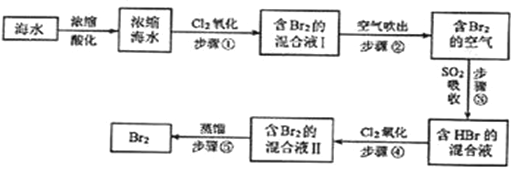
请回答下列问题.
(1)将海水浓缩的方法是__;
(2)步骤①反应的离子方程式是__,1molCl2参加反应,转移电子__mol;
(3)步骤②通入热空气吹出Br2,利用了Br2的__(填序号);
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)步骤③中用SO2的水溶液吸收Br2,吸收率可达95%,该反应的氧化剂是__,在工业生产中此步骤应解决的问题是__.
【答案】 蒸发 Cl2+2Br﹣=2Cl﹣+Br2 2 C Br2 吸收尾气,防止污染空气
【解析】海水蒸发浓缩酸化得到浓缩海水通入氯气氧化溴离子得到含溴单质的混合溶液,利用热空气吹出Br2,被二氧化硫吸收得到含HBr的混合溶液,通入氯气氧化得到溴单质,富集溴元素得到含Br2的混合溶液Ⅱ,蒸馏得到溴单质,则
(1)海水通过蒸发浓缩得到浓缩海水,将海水浓缩的方法是蒸发;(2)步骤①是氯气氧化溴离子得到溴单质,反应的离子方程式是Cl2+2Br-=2Cl-+Br2,依据元素化合价变化计算1molCl2参加反应,转移电子物质的量为2mol;(3)通入热空气吹出Br2,利用了Br2的挥发性,故选C;(4)用SO2的水溶液吸收Br2,氧化剂为溴单质,二氧化硫和溴蒸气有毒不能排放到空气中,应进行尾气吸收。


科目:高中化学 来源: 题型:
【题目】废物的处理、转化和利用是非常有意义的。某研究性学习小组设计如图所示流程,综合处理某工厂印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)和废气(H2S),真正做到了变废为宝:处理废液、废气得到氯化铜、单质硫的同时,还实现了蚀刻液的循环利用。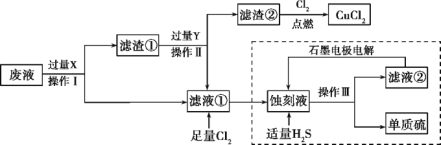
根据以上信息回答下列问题:
(1)操作I、Ⅱ、Ⅲ相同,名称是__,所需要的玻璃仪器主要有:烧杯、玻璃棒、__。
(2)通常用来检验蚀刻液中金属阳离子的化学试剂是__。
(3)向废液中加入过量X时发生的主要反应的离子方程式为__。
(4)滤渣①与Y反应的化学方程式为____。
(5)H2S通入蚀刻液中发生的主要反应为___。
(6)电解池中H+在阴极放电产生H2,阳极的电极反应式为__。
(7)综合分析虚线框内所涉及的两个反应,可知该过程有两个显著优点:①蚀刻液得到循环利用;②__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应,下列说法正确的是( )
① 2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2;
②2NaIO3+5NaHSO3= 2Na2SO4+3NaHSO4+H2O+I2
A. 两个反应中NaHSO4均为氧化产物
B. 碘元素在反应①中被还原,在反应②中被氧化
C. 氧化性:MnO2>SO![]() >IO
>IO![]() >I2
>I2
D. 反应①、②中生成等量的I2时转移电子数比为1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知四种物质的相互转化关系如下:
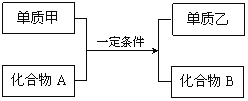
(1)若甲是一种活泼金属单质,化合物B是烧碱。该反应的化学方程式为_________;标准状况下,生成3.36L单质乙,转移电子数为___________。
(2)若甲是国防金属,工业上B可作优质的耐高温材料,乙是黑色非金属固体单质。该反应的化学方程式为_______________,在该反应中化合物A为________(填“氧化剂”或“还原剂”)。
(3)若甲是一种黄绿色气体单质,A的焰色反应为黄色,单质乙能使淀粉溶液变蓝。该反应的化学方程式为_______________。用四氯化碳将单质乙从它的水溶液中提取出来,这种实验操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以柏林绿Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法正确的是

A. 放电时,Mo箔上的电势比Mg箔上的低
B. 充电时,Mo箔接电源的负极
C. 放电时,正极反应为Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6]
D. 充电时,外电路中通过0.2mol电子时,阴极质量增加3.55g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。
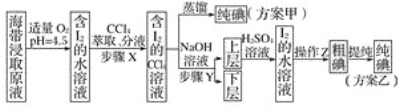
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应的实验,能达到实验目的的是( )
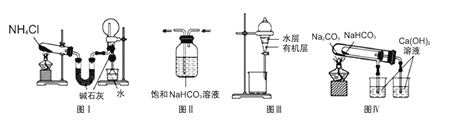
A.图I用于实验室制取氨气并收集干燥的氨气
B.图II用于除去CO2中含有的少量HCl
C.图III用于提取I2的CCl4溶液中的I2
D.图IV装置用于验证NaHCO3和Na2CO3的热稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图容器底部是培养基,其中含有植物生长所需的全部养分,如果有人在配制培养基的矿质元素中使用了NH4NO3、KNO3、CaCl2·2H2O、MgSO4·7H2O、螯合铁溶液、微量元素溶液,但缺少了一种必需元素,为补充这种元素,应添加的化合物是( )
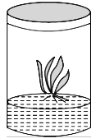
A.Ca(NO3)2B.KClC.KH2PO4D.K2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,此反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、Cr2(SO4)3、K2SO4、H2O七种物质。
(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,其所具有的性质是__________。
①丁达尔效应 ②加入饱和(NH4)2SO4溶液产生聚沉 ③可通过半透膜
(2)请用上述物质填空,并配平化学方程式:____C+____+____H2SO4→____K2SO4+________+____Cr2(SO4)3+____H2O。
(3)H2SO4在上述反应中表现出来的性质是________(填选项编号)。
A.氧化性 B.氧化性和酸性
C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com