
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。
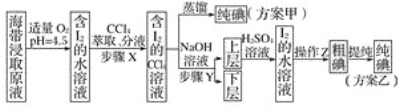
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
【答案】向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞处是否漏水 液体分上下两层,下层呈紫红色 AB 5NaI+NaIO3+3H2SO4===3Na2SO4+3I2↓+3H2O 过滤 碘易升华,会导致碘的损失
【解析】
(1)分液漏斗的检漏方法是:向分液漏斗中加入少量水,检查旋塞处是否漏水;将漏斗倒转过来,检查玻璃塞处是否漏水。
(2)碘水中加入CCl4萃取的现象是:液体分上下两层,下层呈紫红色。
(3)步骤Y是用NaOH溶液反萃取,为了将CCl4中溶解的I2全部转化成易溶于水的离子,要使用稍过量的NaOH溶液,故“应控制NaOH溶液的浓度和体积”,选项A、B正确。
(4)“上层”溶液中的溶质是NaI和NaIO3,加入H2SO4溶液后发生归中反应生成固体碘: 5NaI+NaIO3+3H2SO4===3Na2SO4+3I2↓+3H2O;过滤分离出粗碘。
(5)碘易升华,会导致碘的损失。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】三聚氰胺含氮量较高,但对人体有害。一些不法乳制品企业为了提高乳制品中蛋白质含量,向乳制品中添加三聚氰胺,使儿童患肾结石。下图所示的实验装置可用来测定三聚氰胺的分子式。

已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成CO2、H2O、N2,实验测得装置B增重0.54 g,C增重1.32 g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是________________________。
(2)需要加热的装置是____________(填字母)。
(3)装置D的作用是_________________________。
(4)F处读数时应该注意:_________________、__________________。
(5)三聚氰胺的分子式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中,溶质的物质的量浓度为1 mol·L1的是( )
A.1 mol HCl溶于1 L 水所得的溶液
B.200 mL 5 mol·L1的NaNO3溶液稀释成1L的溶液
C.6.2 g Na2O溶于水配成100mL的溶液
D.K+物质的量浓度为1mol·L1的K2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.向FeCl2溶液中通入Cl2:Fe2+Cl2═Fe3++2C1-
B.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2
C.向小苏打溶液中滴加盐酸;CO32-+2H+═H2O+CO2
D.向NH4Cl溶液中滴入烧碱溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
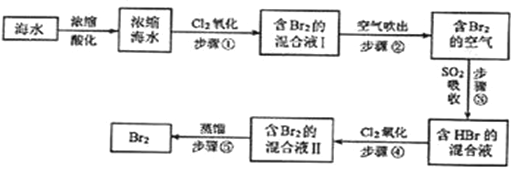
【题目】海水中溴元素以Br﹣形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图:
请回答下列问题.
(1)将海水浓缩的方法是__;
(2)步骤①反应的离子方程式是__,1molCl2参加反应,转移电子__mol;
(3)步骤②通入热空气吹出Br2,利用了Br2的__(填序号);
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(4)步骤③中用SO2的水溶液吸收Br2,吸收率可达95%,该反应的氧化剂是__,在工业生产中此步骤应解决的问题是__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作氧化剂的是( )
A.NaOH+HCl=NaCl+H2O
B.Zn+2HCl=ZnCl2+H2↑
C.MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.CuO+2HCl=CuCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2O2(l)═2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法不正确的是

A. 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰
B. 2molH2O2(l)的能量高于2molH2O(l)的能量
C. 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ
D. 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图所示的是探究金属腐蚀条件的实验装置图,请分析实验并回答下列问题:

(1)若起始时甲、乙、丙3套装置的导管中液面高度相同,过一段时间后液面最高的是________。
(2)通过甲、乙装置的对比说明钢铁中碳的含量越________(填“高”或“低”),钢铁越易腐蚀。
(3)乙装置中发生电化学腐蚀时正极的电极反应式为_________________________________。
Ⅱ.利用化学反应:2FeCl3+Cu=2FeCl2+CuCl2,请你选择合适的电极材料和电解质溶液,设计一个原电池。可供选择的电极材料:铁棒、铜棒、石墨棒。可供选择的电解质溶液:CuCl2溶液、FeCl2溶液、FeCl3溶液。
请填写下列空白:
(1)选择________作正极材料,________作负极材料;选择________作电解质溶液。
(2)写出有关的电极反应式:正极:__________________;负极:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空。
(1)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为______。
(2)在一定的温度和压强下,1体积 X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是________。
(3)将50 mL 0.1 mol·L![]() 的NaCl和100 mL 0.05 mol·L
的NaCl和100 mL 0.05 mol·L![]() CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为________。
CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为________。
(4)三种正盐的混合溶液中含有0.2 mol Na+、0.25 mol Mg2+、0.4 mol Cl-、SO42-,则n(SO42-)为_________。
(5)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。
(6)标准状况下,NH3与CH4组成的混合气体的密度为0.75g/L,该混合气体的平均摩尔质量为_____________,NH3的体积分数为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com