
【题目】下列离子方程式正确的是( )
A.向FeCl2溶液中通入Cl2:Fe2+Cl2═Fe3++2C1-
B.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2
C.向小苏打溶液中滴加盐酸;CO32-+2H+═H2O+CO2
D.向NH4Cl溶液中滴入烧碱溶液并加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2molL﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 molB. 0.25 molC. 0.3 molD. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用以下三种途径来制取相同质量的硝酸铜:
①铜与浓硝酸反应;
②铜与稀硝酸反应;
③铜与氧气反应生成氧化铜,氧化铜再与硝酸反应。下列叙述正确的是
A.三种途径所消耗的铜的物质的量不相等
B.三种途径所消耗的硝酸的物质的量相等
C.所消耗铜的物质的量是:途径③>途径①>途径②
D.所消耗硝酸的物质的量是:途径①>途径②>途径③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl2,下列收集Cl2的装置中正确的是_______(填字母)。
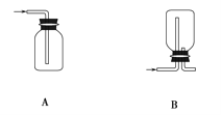
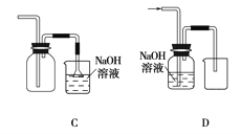
漂白粉能与盐酸发生反应,但盐酸浓度不同时,漂白粉与盐酸混合发生反应的类型不同,漂白粉与稀盐酸发生复分解反应以增强漂白性,化学方程式为_________。漂白粉与浓盐酸发生氧化还原反应会生成氯气,化学方程式为____________。
(2)图1是某同学制备氯水的装置图。
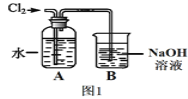
①装置B中发生反应的化学方程式为__________________。
②检验一瓶氯水是否已经完全变质,可选用的试剂是______________(填序号)。
A.硝酸银溶液B.酚酞溶液 C.碳酸钠溶液 D.紫色石蕊溶液
③氯水久置变质的主要反应方程式表示为______________________。
(3)已知氧化性:Br2>Fe3+。若在溴化亚铁溶液中通入氯气,首先被氧化的离子是_______(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知四种物质的相互转化关系如下:
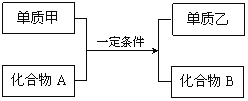
(1)若甲是一种活泼金属单质,化合物B是烧碱。该反应的化学方程式为_________;标准状况下,生成3.36L单质乙,转移电子数为___________。
(2)若甲是国防金属,工业上B可作优质的耐高温材料,乙是黑色非金属固体单质。该反应的化学方程式为_______________,在该反应中化合物A为________(填“氧化剂”或“还原剂”)。
(3)若甲是一种黄绿色气体单质,A的焰色反应为黄色,单质乙能使淀粉溶液变蓝。该反应的化学方程式为_______________。用四氯化碳将单质乙从它的水溶液中提取出来,这种实验操作是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设nA为阿伏伽德罗常数的数值,下列说法正确的是
A. 23g Na 与足量H2O反应完全后可生成nA个H2分子
B. 1 molCu和足量热浓硫酸反应可生成nA个SO3分子
C. 标准状况下,22.4L N2和H2混合气中含nA个原子
D. 3mol单质Fe完全转变为Fe3O4,失去8nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。
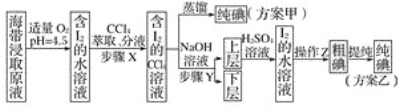
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃时,将ag NH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg·cm-3,溶质的质量分数为w,其中含![]() 的物质的量为bmol。下列叙述中正确的是( )
的物质的量为bmol。下列叙述中正确的是( )
A.溶质的质量分数为w=![]() ×100%
×100%
B.上述溶液中再加入VmL水后,所得溶液溶质的质量分数大于0.5w
C.溶液中c(OH-)=![]() mol·L-1
mol·L-1
D.溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下: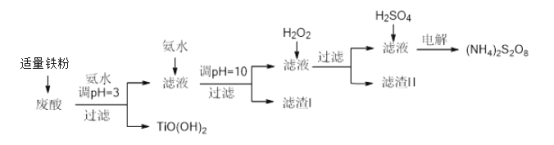
已知:i.部分离子完全生成氢氧化物沉淀的pH:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)加入适量铁的作用是______________________________________。
(2)生成TiO(OH)2的化学方程式是________________________________。
(3)滤渣I、滤渣Ⅱ中均含有的物质的化学式是___________________________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:
2[Fe(NH3)2]2+ +____________+4H2O +H2O2 =___________ + 4NH3·H2O 。
(5)常温下,电解液中含硫微粒主要存在形式与pH的关系如下图所示。
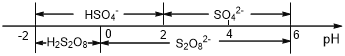
在阳极放电的离子主要为HSO4-,阳极区电解质溶液的pH范围为___________________________________
(6)已知Ksp[Al(OH)3]=3.2×10-34 ,当pH=10 时,求溶液中c(Al3+)=______________
(7)25℃,pH=3的(NH4)2SO4溶液中,计算2c(SO42-)- c(NH4+) =_______mol/L(列式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com