
【题目】利用“化学计量在实验中的应用”的相关知识进行填空。
(1)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为______。
(2)在一定的温度和压强下,1体积 X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是________。
(3)将50 mL 0.1 mol·L![]() 的NaCl和100 mL 0.05 mol·L
的NaCl和100 mL 0.05 mol·L![]() CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为________。
CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为________。
(4)三种正盐的混合溶液中含有0.2 mol Na+、0.25 mol Mg2+、0.4 mol Cl-、SO42-,则n(SO42-)为_________。
(5)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。
(6)标准状况下,NH3与CH4组成的混合气体的密度为0.75g/L,该混合气体的平均摩尔质量为_____________,NH3的体积分数为___________。
【答案】4:3 XY3或Y3X 0.1mol/L 0.15mol 6:3:2 16.8g/mol 80%
【解析】
(1)NH3与CH4含相同数目的H原子,则H原子物质的量相等;
(2)一定的温度和压强下气体的体积之比等于其物质的量之比,等于化学方程式的系数之比,化学反应遵循原子守恒;
(3)先分别利用n=c·V来计算溶液中溶质的物质的量,从而确定Cl-的物质的量,最后利用c=![]() 来计算混合液中Cl-的物质的量浓度;
来计算混合液中Cl-的物质的量浓度;
(4)根据溶液电荷守恒分析;
(5)若生成沉淀AgCl的质量相等,设AgCl为1mol,根据氯离子守恒计算NaCl、CaCl2、AlCl3的物质的量,再根据c=![]() 确定溶液的浓度关系;
确定溶液的浓度关系;
(6)依据M=ρ标·Vm;设NH3与CH4的物质的量分别为x、y,依据混合气体平均摩尔质量计算二者物质的量之比。
(1)要使NH3与CH4含相同数目的H原子,由于NH3与CH4分子中含H原子个数比为3:4,所以NH3和CH4的物质的量之比为4:3;
(2)由题意可知,一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,气体的体积之比等于其物质的量之比,等于化学方程式的系数之比,所以反应物X2和Y2的系数之比是1:3,根据原子守恒可知发生反应为:X2+3Y2=2XY3,所以化合物化学式为XY3,也可以写为Y3X;
(3)NaCl的物质的量为0.05L×0.1mol/L=0.005mol,CaCl2的物质的量为0.1L×0.05mol/L×2=0.01mol,则混合溶液中Cl-的物质的量为0.005mol+0.01mol=0.015mol,混合溶液的体积为0.05L+0.1L=0.15L,则混合液中Cl-的物质的量浓度为c=![]() =0.1mol/L;
=0.1mol/L;
(4)溶液中阳离子带有的正电荷总数与阴离子带有的负电荷总数相等,则n(Na+)+2n(Mg2+)=n(Cl-)+2n(SO42-),将各种离子浓度带入上式,0.2mol+0.25mol×2=0.4 mol+2n(SO42-),解得n(SO42-)=0.15mol;
(5)若生成沉淀AgCl的质量相等,设AgCl为1mol,根据氯离子守恒,则n(NaCl)=1mol、n(CaCl2)=0.5mol,n(AlCl3)=![]() mol,故NaCl、CaCl2、AlCl3的物质的量之比=1mol:0.5mol:
mol,故NaCl、CaCl2、AlCl3的物质的量之比=1mol:0.5mol:![]() =6:3:2。溶液的体积相同,根据c=
=6:3:2。溶液的体积相同,根据c=![]() 可知:溶液的浓度比等于溶液中溶质的物质的量的比,所以c(NaCl):c(CaCl2):c(AlCl3)= 6:3:2。
可知:溶液的浓度比等于溶液中溶质的物质的量的比,所以c(NaCl):c(CaCl2):c(AlCl3)= 6:3:2。
(6)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,混合气体平均摩尔质量: m=ρ·Vm=0.75g/L×22.4L/mol=16.8g/mol;设NH3与CH4的物质的量分别为x、y,则![]() =16.8,解得x:y=4:1,气体的物质的量比等于体积比,则NH3的体积分数为
=16.8,解得x:y=4:1,气体的物质的量比等于体积比,则NH3的体积分数为![]() 100%=80%。
100%=80%。


科目:高中化学 来源: 题型:
【题目】碘及其化合物在科研、生活等方面有广泛用途。如图所示为从海带中制取碘的工艺流程。
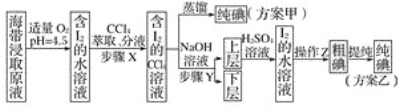
已知:3I2+6NaOH===5NaI+NaIO3+3H2O。
请回答下列问题:
(1)分液漏斗使用前需要检漏,检漏方法为__________。
(2)步骤X中,萃取后分液漏斗内观察到的现象是_____________。
(3)下列有关步骤Y的说法中正确的是_____(填字母)。
A.应控制NaOH溶液的浓度和体积
B.将碘单质转化成碘离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH溶液可以用乙醇代替
(4)向“上层”中加入H2SO4溶液,发生反应的化学方程式为____,操作Z的名称为________。
(5)方案甲中采用蒸馏不合理,理由是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
A. 分子总数为NA的二氧化硫和二氧化碳混合气体中含有的原子数为3NA
B. 任何条件下,20 L 氧气含有的分子数都不可能为NA
C. 在标准状况下,2 g氖气含有NA个氖原子
D. 物质的量相等的任何气体中都含有相同的原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下: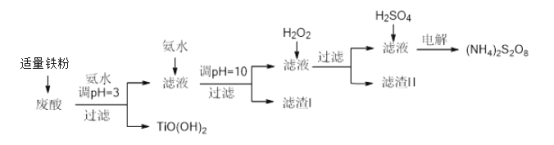
已知:i.部分离子完全生成氢氧化物沉淀的pH:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)加入适量铁的作用是______________________________________。
(2)生成TiO(OH)2的化学方程式是________________________________。
(3)滤渣I、滤渣Ⅱ中均含有的物质的化学式是___________________________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:
2[Fe(NH3)2]2+ +____________+4H2O +H2O2 =___________ + 4NH3·H2O 。
(5)常温下,电解液中含硫微粒主要存在形式与pH的关系如下图所示。
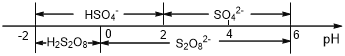
在阳极放电的离子主要为HSO4-,阳极区电解质溶液的pH范围为___________________________________
(6)已知Ksp[Al(OH)3]=3.2×10-34 ,当pH=10 时,求溶液中c(Al3+)=______________
(7)25℃,pH=3的(NH4)2SO4溶液中,计算2c(SO42-)- c(NH4+) =_______mol/L(列式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,此反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、Cr2(SO4)3、K2SO4、H2O七种物质。
(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,其所具有的性质是__________。
①丁达尔效应 ②加入饱和(NH4)2SO4溶液产生聚沉 ③可通过半透膜
(2)请用上述物质填空,并配平化学方程式:____C+____+____H2SO4→____K2SO4+________+____Cr2(SO4)3+____H2O。
(3)H2SO4在上述反应中表现出来的性质是________(填选项编号)。
A.氧化性 B.氧化性和酸性
C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将0.1molL﹣1 NaOH溶液加入20mL0.1molL﹣1CH3COOH溶液中,所加入溶液的体积(V)和混合液的pH关系曲线如图所示。下列结论正确的是( )
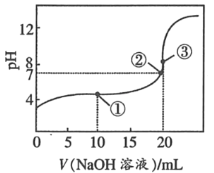
A.①点时,c(CH3COO﹣)+c(CH3COOH)=c(Na+)
B.对曲线上①②③任何一点,溶液中都有c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
C.③点时,醋酸恰好完全反应完溶液中有c(CH3COO﹣)=c(Na+)>c(H+)=c(OH﹣)
D.滴定过程中可能出现c(H+)>c(Na+)>c(CH3COO﹣)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O35H2O俗称“海波”,是重要的化工原料,常用作脱氯剂、定影剂和还原剂。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO42﹣,常用作脱氯剂,该反应的离子方程式是_____。
(2)测定海波在产品中的质量分数:依据反应2S2O32﹣+I2=S4O62﹣+2I﹣,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉溶液为指示剂,用浓度为0.05000molL﹣1I2的标准溶液进行滴定,相关数据记录如表所示。
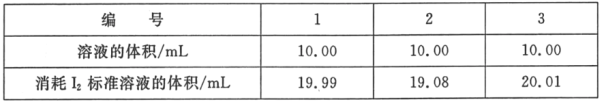
①判断滴定终点的现象是_____。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O35H2O的质量分数会_____(填“偏高”、“偏低”或“不变”)
③计算海波在产品中的质量分数(写出计算过程)。_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KCl样品中含有少量KOH、K2SO4和不溶于水的杂质,为了提纯KCl,某同学先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作
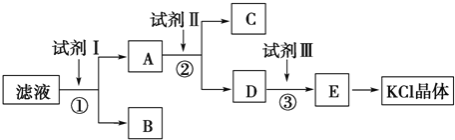
(1)试剂Ⅰ的化学式为__________,其作用是除去__________(填离子符号),
检验该离子完全除尽的操作是__________________________________________
(2)加入试剂Ⅱ时发生反应的化学方程式为_____________________________
(3)试剂Ⅲ的名称是__________,各步操作中所加试剂都必须过量,欲检验试剂Ⅲ已经过量,可以选用__________(填字母).
A.AgNO3 B.pH试纸 C.K2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
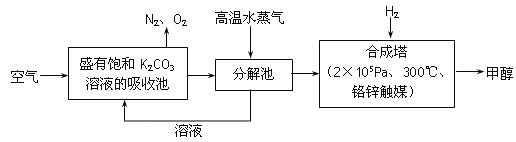
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式是______________________________________。
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:
CH3OH + H2O - 6e-=== CO2 + 6H+
则正极发生的反应是__________;放电时,H+移向电池的______(填“正”或“负”)极。
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+ 的平衡常数K=_____________。(已知:10-5.6=2.5×10-6)
HCO3-+H+ 的平衡常数K=_____________。(已知:10-5.6=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)________c(CO32-) (填“>”、“=”或“<”),原因是________________________(用离子方程式和必要的文字说明)。
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小李应该选用的试剂是___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com