
【题目】为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
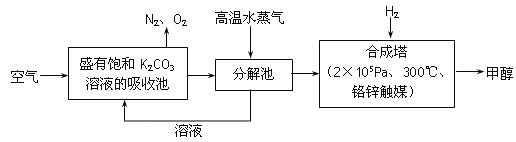
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式是______________________________________。
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:
CH3OH + H2O - 6e-=== CO2 + 6H+
则正极发生的反应是__________;放电时,H+移向电池的______(填“正”或“负”)极。
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3-+H+ 的平衡常数K=_____________。(已知:10-5.6=2.5×10-6)
HCO3-+H+ 的平衡常数K=_____________。(已知:10-5.6=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)________c(CO32-) (填“>”、“=”或“<”),原因是________________________(用离子方程式和必要的文字说明)。
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小李应该选用的试剂是___________________。
【答案】CO2(g)+3H2(g)=== CH3OH(g)+H2O(g)ΔH=-49.47kJ/mol O2+ 4H+ + 4e-=2 H2O 正 4.2×10-7mol·L-1 > 因为既存在 HCO3-![]() CO32-+H+ 也存在HCO3-+H2O
CO32-+H+ 也存在HCO3-+H2O![]() H2CO3+OH-、而HCO3-的水解程度大于电离程度 Ba(OH)2(或NaOH溶液和BaCl2溶液)
H2CO3+OH-、而HCO3-的水解程度大于电离程度 Ba(OH)2(或NaOH溶液和BaCl2溶液)
【解析】
(1)合成塔中发生反应为二氧化碳与氢气反应生成甲醇和水,根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量,据此写出反应的热化学方程式;
(2)氧气在正极上被还原,在酸性条件下生成水,由此写出电池正极电极反应式;电池的正极上有聚集的电子,放电时,电解质溶液的阳离子向电池的正极移动;
(3)电离平衡常数指弱电解质在一定条件下电离达到平衡时,溶液中电离所生成的各种离子浓度系数次幂的乘积,跟溶液中未电离分子的浓度系数次幂的乘积的比值,则H2CO3HCO3-+H+的平衡常数K= ![]() ;
;
(4)溶液中存在平衡 HCO3-CO32-+H+、HCO3-+H2OH2CO3+OH-,而HCO3-的水解程度大于电离程度;
(5)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全。
(1)根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量,所以热化学方程式为CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol;
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol;
(2)氧气在正极上被还原,在酸性条件下生成水,电池正极电极反应式为O2+4H++4e-=2H2O,电池的正极上有聚集的电子,放电时,电解质溶液的阳离子向电池的正极移动,即H+移向电池的正极;
故答案为:O2+4H++4e-=2H2O;正;
(3)饱和CO2水溶液的pH=5.6,所以c(H+)=10-5.6=2.5×10-6mol/L,c(H2CO3)=1.5×10-5molL-1,则H2CO3HCO3-+H+的平衡常数,K= ![]() =
=![]() =4.2×10-7molL-1;
=4.2×10-7molL-1;
故答案为:4.2×10-7molL-1;
(4)溶液中存在平衡 HCO3-CO32-+H+、HCO3-+H2OH2CO3+OH-,而HCO3-的水解程度大于电离程度,所以溶液中c(H2CO3)>c(CO32-);
故答案为:>;溶液存在平衡 HCO3-CO32-+H+、HCO3-+H2OH2CO3+OH-,而HCO3-的水解程度大于电离程度;
(5)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全,故可选择Ba(OH)2(或NaOH溶液和BaCl2溶液)作为CO2的沉淀剂;
故答案为:Ba(OH)2(或NaOH溶液和BaCl2溶液)。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识进行填空。
(1)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为______。
(2)在一定的温度和压强下,1体积 X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是________。
(3)将50 mL 0.1 mol·L![]() 的NaCl和100 mL 0.05 mol·L
的NaCl和100 mL 0.05 mol·L![]() CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为________。
CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为________。
(4)三种正盐的混合溶液中含有0.2 mol Na+、0.25 mol Mg2+、0.4 mol Cl-、SO42-,则n(SO42-)为_________。
(5)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为_____________。
(6)标准状况下,NH3与CH4组成的混合气体的密度为0.75g/L,该混合气体的平均摩尔质量为_____________,NH3的体积分数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3+5O2![]() 4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率v(v表示反应物的消耗速率或生成物的生成速率)为
4NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则此反应的平均速率v(v表示反应物的消耗速率或生成物的生成速率)为
A. (NH3)= 0.002mol/(L·s)B. (O2)= 0.01mol/(L·s)
C. (NO)= 0.008mol/(L·s)D. (H2O)= 0.004mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A元素的一种单质是重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料—光导纤维,C与烧碱反应生成含A元素的化合物D。
(1)易与C发生化学反应的酸是________,反应的化学方程式是_______________ 。
(2)将C与纯碱混合,在高温熔融时发生化学反应也可生成D,同时还生成B的最高价氧化物E;将E与D在足量的水中混合后,又发生化学反应生成含A的化合物F。
①写出生成D和F的化学反应方程式:____________________、__________________。
②要将纯碱在高温下熔化,下列坩埚中不可选用的是________。
A.普通玻璃坩埚 B.石英玻璃坩埚 C.瓷坩埚 D.铁坩埚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制98 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒 F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为 ______ mL。
(2)实验时选用的仪器有(填序号)_______
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)_____
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)_______
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
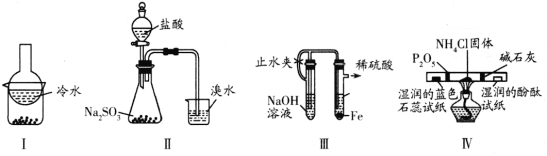
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA
B.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA
C.标准状况下,11.2L水中含有分子的数目为0.5NA
D.在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
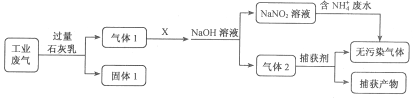
A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁镁合金是目前已发现的储氢密度较高的储氢材料之一,其晶胞结构如图所示(黑球代表Fe,白球代表Mg)。则下列说法不正确的是
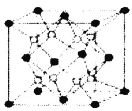
A.铁镁合金的化学式为Mg2Fe
B.晶体中存在的化学键类型为共价键
C.晶格能:氧化镁>氧化钙
D.该晶胞的质量是![]() g(NA表示阿伏加德罗常数的值)
g(NA表示阿伏加德罗常数的值)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com