
����Ŀ��AԪ�ص�һ�ֵ�������Ҫ�İ뵼����ϣ���AԪ�ص�һ�ֻ�����C��������������ܵ��ִ�ͨѶ���������ά��C���ռӦ���ɺ�AԪ�صĻ�����D��
(1)����C������ѧ��Ӧ������________����Ӧ�Ļ�ѧ����ʽ��_______________ ��
(2)��C�봿���ϣ��ڸ�������ʱ������ѧ��ӦҲ������D��ͬʱ������B�����������E����E��D��������ˮ�л�Ϻ��ַ�����ѧ��Ӧ���ɺ�A�Ļ�����F��
��д������D��F�Ļ�ѧ��Ӧ����ʽ��____________________��__________________��
��Ҫ�������ڸ������ۻ������������в���ѡ�õ���________��
A����ͨ�������� B��ʯӢ�������� C�������� D��������
���𰸡������ SiO2��4HF=SiF4����2H2O SiO2��Na2CO3![]() Na2SiO3��CO2�� Na2SiO3��CO2��H2O=Na2CO3��H2SiO3�� ABC
Na2SiO3��CO2�� Na2SiO3��CO2��H2O=Na2CO3��H2SiO3�� ABC
��������
��AԪ�ص�һ�ֵ�������Ҫ�İ뵼�������˵��AΪSi��ͨ�������ά�����Ʋ�CΪSiO2��SiO2���ռ�������Ʒ�Ӧ���ɵĺ�SiԪ�صĻ�����ΪNa2 SiO3��SiO2�봿�̼���Ƹ�������������Na2 SiO3��CO2����BΪC��EΪCO2��������̼������������ˮ�п����ɹ����̼���ƣ���FΪH2SiO3��
��1��SiO2��������ᷢ����Ӧ���ʴ�Ϊ������![]() ��
��
��2���ٸ��ݷ�����֪��Ϊ��![]() ��
��![]() ��
��
��A����ͨ���������к���SiO2�����ڸ������봿�Ӧ����A�����B��ʯӢ���������к���SiO2�����ڸ������봿�Ӧ����B�����C��������к���SiO2�����ڸ������봿�Ӧ����C�����D���������в��������������봿�Ӧ�����ʣ���D����ȷ���ʴ�Ϊ��ABC��


 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ѱ۳����ᣨ��Ҫ�����ᡢFe3+��Fe2+��TiO2+��Al3+���Ʊ����������[(NH4)2S2O8]��ͬʱ����TiO(OH)2�ļ�Ҫ�������£�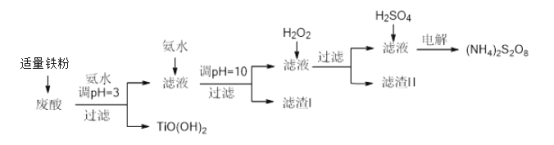
��֪��i.����������ȫ�����������������pH��
�������� | TiO2+ | Fe3+ | Fe2+ | Al3+ |
��ʼ������PH | 1.2 | 1.9 | 7.0 | 3.2 |
������ȫ��pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7ʱ��Fe2+��������Fe(II)��������[Fe(NH3)2]2+��
��ش��������⣺
��1��������������������______________________________________��
��2������TiO(OH)2�Ļ�ѧ����ʽ��________________________________��
��3������I���������о����е����ʵĻ�ѧʽ��___________________________��
��4������H2O2��Ŀ������������Fe(II)��������[Fe(NH3)2]2+����ƽ�������ӷ���ʽ��
2[Fe(NH3)2]2+ +____________+4H2O +H2O2 =___________ + 4NH3��H2O ��
��5�������£����Һ�к�������Ҫ������ʽ��pH�Ĺ�ϵ����ͼ��ʾ��
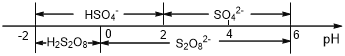
�������ŵ��������ҪΪHSO4-���������������Һ��pH��ΧΪ___________________________________
��6����֪Ksp[Al(OH)3]=3.2��10-34 ����pH=10 ʱ������Һ��c(Al3+)=______________
��7��25�棬pH=3��(NH4)2SO4��Һ�У�����2c(SO42-)- c(NH4+) =_______mol/L����ʽ���ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KCl��Ʒ�к�������KOH��K2SO4�Ͳ�����ˮ�����ʣ�Ϊ���ᴿKCl��ijͬѧ�Ƚ���Ʒ��������ˮ�У���ֽ������ˣ��ٽ���Һ����ͼ��ʾ������в���
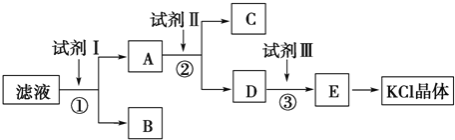
(1)�Լ���Ļ�ѧʽΪ__________���������dz�ȥ__________�������ӷ��ţ���
�����������ȫ�����IJ�����__________________________________________
(2)�����Լ���ʱ������Ӧ�Ļ�ѧ����ʽΪ_____________________________
(3)�Լ����������__________�����������������Լ�������������������Լ����Ѿ�����������ѡ��__________������ĸ����
A��AgNO3 B��pH��ֽ C��K2CO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��ͬ���ʵ������ơ�þ�������������ᷴӦʱ�ų������������Ϊ__________���ֱ�Ϊ0.3 mol���ơ�þ����Ͷ��100 mL 1 mol��L-1��������Һ�У����߲������������_______��
(2)��һ�������Ƶ��������ڳ���CO2���壬Ȼ��������ע��������NaOH��Һ�������ý����ܷ�ڡ�����һ��ʱ��ޱ��ڰ������ٹ�һ��ʱ����˵Ĺޱ����¹��������ޱ��ڰ������ԭ����_____________�����ӷ���ʽ����Ϊ____________________�����ٹ����ԭ����________________�����ӷ���ʽ����Ϊ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Ҫ�����ᱵ������ͭ���������ȣ����ʲ��μӷ�Ӧ�������ÿ�����ȡ�����Ĺ���������ͼ��ʾ���ҡ������������Ϊ���ʣ���

�ش��������⣺
��1��������Ϊ_____________(�ǿ�����������ǡ�������ʡ�
��2�����ճ���������Ҫ�ķDz���������������__________��___________��__________��
��3����Һ�ٵ���Ҫ�ɷ�Ϊ___________________________��
��4����Һ���м����������ᷢ�������ӷ���ʽΪ_______________��__________________��
��5����Ӧ�ٵķ�Ӧ������________________________��
��6�������Һ��ʱ�����ĵ缫��ӦʽΪ_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л��ϳ��г��õ��ܼ���ijʵ��С����ʵ���������Ҵ���ˮ�Ʊ����ѣ�װ��ʾ��ͼ���гֺͼ���װ������ȥ�����й����ݺ�ʵ�鲽�����£�
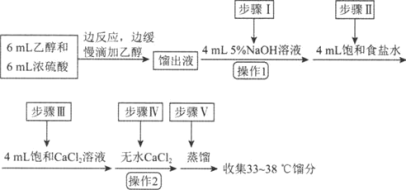
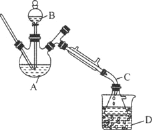
���� | ��Է������� | �ܶȣ���g��mL��1�� | �е㣯�� | ��ˮ�е��ܽ��� |
�Ҵ� | 46 | 0.816 | 78 | ���� |
���� | 74 | 0.713 | 34.6 | ���� |
��֪������ͬ�����£������ڱ���ʳ��ˮ�б���ˮ�и����ܡ�
���Ȼ��ƿ����Ҵ��γ������CaCl2��6C2H5OH��
��ش��������⣺
��1������B������Ϊ________��
��2�����Ҵ��Ʊ����ѵ��ܷ�ӦΪ2C2H5OH![]() CH3CH2OCH2CH3��H2O���˷�Ӧ���������У���һ����Ӧ�Ļ�ѧ����ʽΪ��CH3CH2OH��H2SO4
CH3CH2OCH2CH3��H2O���˷�Ӧ���������У���һ����Ӧ�Ļ�ѧ����ʽΪ��CH3CH2OH��H2SO4![]() CH3CH2OSO2OH��H2O����ڶ�����Ӧ�Ļ�ѧ����ʽΪ________��
CH3CH2OSO2OH��H2O����ڶ�����Ӧ�Ļ�ѧ����ʽΪ________��
��3����Ӧ�����У�����B��ĩ��Ӧ���뷴ӦҺ�У�ԭ����________________��
��4������D��ʢ�б�ˮ����������Ϊ________________��
��5������1������Ϊ________������2������Ϊ________��
��6����ʡ�Բ������ᵼ�µĺ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о�������п�ѧ���������ɫ���������룺�ѿ�������̼�����Һ��Ȼ���ٰ�CO2����Һ����ȡ����������ѧ��Ӧ��ʹ֮��Ϊ������ȼ�ϼ״�������ɫ���������뼼���������£�
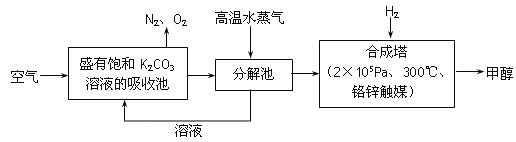
��1���ںϳ����У�����4.4kg CO2������H2ǡ����ȫ��Ӧ���ɷų�4947 kJ����������д���ϳ����з�����Ӧ���Ȼ�ѧ����ʽ��______________________________________��
��2���Լ״�Ϊȼ����������ȼ�ϵ�أ���ص�����ͨ��O2������ͨ��״�����������Һ�м״�������������ˮ�Ͷ�����̼���õ�ظ��������ķ�Ӧ�ǣ�
CH3OH + H2O �� 6e��=== CO2 + 6H+
�����������ķ�Ӧ��__________���ŵ�ʱ��H�������ص�______������������������������
��3�����³�ѹ�£�����CO2ˮ��Һ��pH=5.6��c(H2CO3)=1.5��10��5mol��L��1��������ˮ�ĵ��뼰H2CO3�ĵڶ������룬��H2CO3![]() HCO3����H+ ��ƽ�ⳣ��K=_____________������֪��10��5.6=2.5��10��6��
HCO3����H+ ��ƽ�ⳣ��K=_____________������֪��10��5.6=2.5��10��6��
��4�������£�0.1 mol��L��1NaHCO3��Һ��pH����8������Һ��c(H2CO3)________c(CO32��) (������������������������)��ԭ����________________________�������ӷ���ʽ�ͱ�Ҫ������˵������
��5��С��ͬѧ���ó������ⶨ������CO2����������������CaCO3��BaCO3���ܶȻ���Ksp���ֱ�Ϊ4.96��10��9��2.58��10��9��С��Ӧ��ѡ�õ��Լ���___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ�������������ˮ�ľ������仯ѧʽ�ɱ�ʾΪ[Fea(OH)b(SO4)c]m��ȡһ�����ۺ���������Ʒ���������ᷴӦ����������Һƽ����Ϊ���ݡ���һ����Һ�м���������BaCl2��Һ���õ���ɫ����1.7475 g��ȡ��һ����Һ���Ƚ�Fe3����ԭΪFe2��(��ԭ������Fe���Ҽ���Ļ�ԭ��ǡ�ý�Fe3����ԭΪFe2��)������0.020 00 mol/LK2Cr2O7����Һ�ζ����յ㣬����K2Cr2O7����Һ50.00 mL���þۺ���������Ʒ��a��bΪ ( )
A.1��1B.2��1C.3��1D.2��5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ŀ��������������ȷ���� ( )
A. ����������ˮ��ȥ��Ч����ǿ��˵�������ˮ�ⷴӦ�����ȷ�Ӧ
B. NH3(g) + HCl(g) = NH4Cl(s) �ڽϵ��¶������Է����У�˵���÷�Ӧ�Ħ�H>0
C. 500�桢30 MPa�£���7 g N2��3 g H2�����ܱ������г�ַ�Ӧ����NH3(g)������19.3 kJ�����Ȼ�ѧ����ʽΪN2(g)��3H2(g)![]() 2NH3(g) ��H����38.6 kJ��mol��1
2NH3(g) ��H����38.6 kJ��mol��1
D. �����ȼ���ȣ���H��Ϊ��890.3 kJ��mol��1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4(g)��2O2(g)�� CO2(g)��2H2O(g)����H����890.3 kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com